
【题目】下列反应在一定条件下进行,反应类型不正确的是( )
A.CH3CH2OH+HO-NO2 → H2O+CH3CH2ONO2 (取代反应)
B.2CH2=CH2+O2 → 2CH3CHO(氧化反应)
C.nCH2=CHCH3 →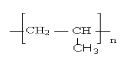 (加聚反应)
(加聚反应)
D.![]() →
→![]() (消去反应)
(消去反应)
科目:高中化学 来源: 题型:
【题目】1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。

回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族。
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)。
A.Ge晶体属于准金属,且为原子晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________。
(4)NH3也常作致冷剂,其键角_______(填“大于”或“小于”)109°28′,主要原因是___________________________________________________________________________。
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个压强不变的容器中,通入![]() 和
和![]() 及固体催化剂,使之反应:
及固体催化剂,使之反应:![]() ,平衡时容器内气体总的物质的量为起始时的
,平衡时容器内气体总的物质的量为起始时的![]() 。保持同一反应温度,在相同容器中,将起始物质的量改为
。保持同一反应温度,在相同容器中,将起始物质的量改为![]() 、
、![]() 、
、![]() ,下列说法正确的是
,下列说法正确的是
A.第一次平衡时反应放出的热量为![]()
B.第二次平衡![]() 的转化率为
的转化率为![]()
C.第二次达平衡时![]() 的体积分数大于
的体积分数大于![]()
D.达平衡时用![]() 表示的反应速率为
表示的反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
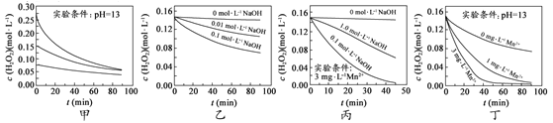
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示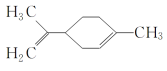 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:

(1)写出下列物质的化学式:A________,B________,写出B的一种危害__________。
(2)写出下列反应的化学方程式:E→F____________;红热的木炭与D的浓溶液反应的方程式:____________;铜与H的浓溶液反应的离子方程式:_____________。
(3)检验某溶液中是否含A 中阳离子的方法_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,碳钢腐蚀与溶液pH的关系如下:
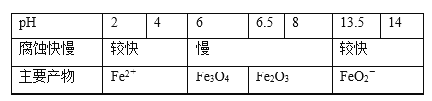
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为___________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com