
(13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
X | |||
Y | Z |
25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13。
(1)Y的离子结构示意图为 。
(2)X、Z的气态氢化物稳定性较强的是 (填化学式)。
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示)。
(4)工业上,用X单质制取Z单质的化学方程式为 。
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 。(已知25℃,X的最高价氧化物的水化物的电离常数为Kal =4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10)
Ⅱ、碳和氮的化合物与人类生产、生活密切相关。低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 |
平衡常数 | 9.94 | 9 |
请回答下列问题:
(6)上述正反应方向是 反应(填“放热”或“吸热”)。
(7)写出该反应的化学平衡常数表达式:K= 。
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(9)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g) Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,ΔH减小
C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低
D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
I、(1) ;
;
(2)CH4
(3)SiO2+2OH-=SiO32-+H2O
(4)SiO2+C Si+CO↑
Si+CO↑
(5)KA+CO2+H2O=HA+KHCO3
II、(6)放热
(7)K=c(H2)c(CO2)/c(CO)c(H2O)
(8)40%;1
(9)C
【解析】
试题分析:I、25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13,说明M是强碱,根据X、Y、Z在元素周期表中的位置判断Y是Na元素,对应的最高价氧化物的水化物是氢氧化钠,为强碱;则X是C元素,Z是Si元素。
(1)Na的离子结构示意图为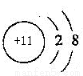 ;
;
(2)C的非金属性大于Si,所以C的气态氢化物CH4的稳定性较强;
(3)因为氢氧化钠与玻璃塞中的二氧化硅反应生成粘性较大的硅酸钠,所以不能用带磨口玻璃塞的试剂瓶盛装氢氧化钠溶液,离子方程式是SiO2+2OH-=SiO32-+H2O;
(4)工业上用单质碳还原二氧化硅制取Si单质,化学方程式是SiO2+C Si+CO↑;
Si+CO↑;
(5)根据所给酸的电离常数可知,酸性H2CO3>HA>HCO3-,所以二氧化碳与KA溶液反应只能生成碳酸氢钾和HA,则化学方程式是KA+CO2+H2O=HA+KHCO3。
II、(6)温度升高,平衡常数减小,说明升高温度,平衡逆向移动,则该反应是放热反应;
(7)根据平衡常数的定义,该反应的平衡常数K=c(H2)c(CO2)/c(CO)c(H2O);
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,则平衡时c(H2)=c(CO2)=2mol/L×60%=1.2mol/L,消耗水蒸气的浓度也是1.2mol/L,则水蒸气的转化率为1.2mol/L/3mol/L×100%=40%;平衡时水蒸气的浓度是3mol/L-1.2mol/L=1.8mol/L,CO的浓度是2mol/L-1.2mol/L=0.8mol/L,代入K=c(H2)c(CO2)/c(CO)c(H2O),则该温度下的平衡常数是1.22/(0.8×1.8)=1;
(9)A、Ni为固体,增加Ni的量,平衡不移动,CO的转化率不变,错误;B、缩小容器容积,压强增大,平衡右移,但ΔH不变,错误;C、反应达到平衡后,充入CO,相当于增大压强,平衡正向移动,则再次达到平衡时,CO的体积分数减小,正确;D、因为该反应有固体参加,气体的总质量分数变化,达到平衡时气体的质量不再变化,则气体的密度不变,所以当容器中混合气体密度不变时,可说明反应已达化学平衡状态,而4v正[Ni(CO)4]= v正(CO)表示正反应速率,不符合正逆反应速率相等的特征,不能判断平衡的到达,错误,答案选C。
考点:考查元素推断,化学用语的书写,化学平衡的移动机平衡常数的应用


科目:高中化学 来源:2014-2015湖南省娄底市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
在298 K、100 kPa时,已知:
Cl2(g)+H2(g)===2HCl(g) ΔH1 2H2O(g)===2H2(g)+O2(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是
A.ΔH3=2ΔH1-ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=2ΔH1+ΔH2 D.ΔH3=ΔH2-ΔH1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:实验题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:

提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是_____,加入Sn粉的作用是____。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_______________。
(3)检验沉淀已经“漂洗”干净的方法__________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0molL-1,则应控制溶液pH______。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.油脂是高分子化台物,水解可生成甘油和高级脂肪酸
B.葡萄糖注射液不能产生丁达尔效应,不属于胶体
C.煤中含有的煤焦油,可由煤干馏获得
D.聚乙烯塑料的老化是因为发生了加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+ == 2Fe(OH)3 +3 Mg2+
B.草酸使酸性KMnO4溶液褪色: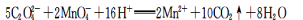
C.往NaHS04溶液中滴加Ba(OH)2至溶液呈中性: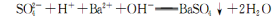
D.向NaCl0溶液中通人少量的CO2:CO2 +2C1O-+H2O == CO32-+ 2 HC1O已知Ka1(H2 CO3)>Ka( HC1O)>Ka2(H2 CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-
离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中一定不正确的是
A.它们的原子序数A>B>C B.它们的离子半径A2->C->B2+
C.它们的原子半径C>B>A D. 它们的最外层电子数C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得
c(CO) = 0.0080 mol·L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com