
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得
c(CO) = 0.0080 mol·L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
X | |||
Y | Z |
25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13。
(1)Y的离子结构示意图为 。
(2)X、Z的气态氢化物稳定性较强的是 (填化学式)。
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示)。
(4)工业上,用X单质制取Z单质的化学方程式为 。
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 。(已知25℃,X的最高价氧化物的水化物的电离常数为Kal =4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10)
Ⅱ、碳和氮的化合物与人类生产、生活密切相关。低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 |
平衡常数 | 9.94 | 9 |
请回答下列问题:
(6)上述正反应方向是 反应(填“放热”或“吸热”)。
(7)写出该反应的化学平衡常数表达式:K= 。
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(9)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g) Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,ΔH减小
C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低
D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是
| X | Y | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |


查看答案和解析>>
科目:高中化学 来源: 题型:
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
A. 将压强减小至原来的一半 B. 将反应温度升高
C. 添加催化剂 D. 增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别
为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(4c+12b-6a-5d)kJ·mol—1 B.(6a+5d-4c-12b)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列叙述正确的是
A.2.24 L CO2中含有的原子数为0.3NA
B.0.1 mol F- 中含有的电子数等于0.9NA
C.5.6 g铁粉与氯气反应失去的电子数为0.2NA
D.电解饱和食盐水若产生2 g氢气,则转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.氧化铝既能和盐酸反应又能和氢氧化钠溶液反应均生成盐和水,说明氧化铝是两性氧化物。
B.NaHCO3的热稳定性比Na2CO3强
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+
D.氯气中含有的少量氯化氢可用氢氧化钠溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s) 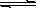 Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
A.溶液中钙离子数目减小 B.溶液中钙离子浓度减少
C.溶液中氢氧根离子浓度增大 D.pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是
A.Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+)
B.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+)
C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:
c(Cl-)>c(NH4+)> c(NH3·H2O)>c(OH-)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:
c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com