
【题目】下列说法正确的是( )
A.同周期元素核电荷数越大,最外层电子数越多
B.最外层电子数越多,原子半径越小
C.从11~17号元素原子的半径逐渐增大
D.核电荷数越大,原子半径越小
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
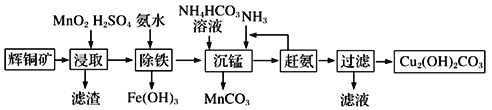
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是( )
A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B. 用于人民币票面文字等处的油墨中所含有的![]() 是一种磁性物质
是一种磁性物质
C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉
D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是( )
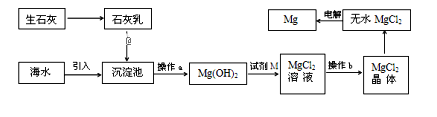
①试剂M是盐酸
②流程中的反应全部都是非氧化还原反应
③操作b只是过滤
④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
A. ①②③④⑤B. ②③C. ④⑤D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
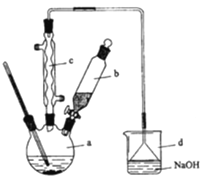
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
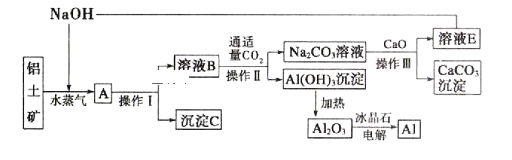
请回答下列问题。
(1)沉淀C的化学式为_______________,该物质除了用于金属冶炼以外,还可用作____________。
(2)电解熔融的氧化铝时,若得到22.4L(标准状况下)![]() ,则同时生成___________g铝。
,则同时生成___________g铝。
(3)操作I、操作II和操作III都是__________(填操作名称),实验室要洗涤,![]() 沉淀应该在____________装置中进行,洗涤方法是_____________________________。
沉淀应该在____________装置中进行,洗涤方法是_____________________________。
(4)生产过程中,除NaOH、![]() 可以循环利用外,还可以循环利用的物质有______________(填化学式),用此法制取铝的副产品是_______________(填化学式)。
可以循环利用外,还可以循环利用的物质有______________(填化学式),用此法制取铝的副产品是_______________(填化学式)。
(5)写出![]() 溶液与CaO反应的离子方程式:_________________________。
溶液与CaO反应的离子方程式:_________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝中将混有杂质_______________(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则
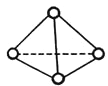
A. 1molN4气体转化为N2时要吸收217kJ能量 B. N4是N2的同位素
C. 1molN4气体转化为N2时要放出724kJ能量 D. N4是一种新型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于取代反应的是( )
A. 乙烯与水反应生成乙醇 B. 甲烷与氯气反应生成一氯甲烷
C. 乙醇与氧气反应生成乙醛 D. 乙烯与高锰酸钾溶液反应生成CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com