
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
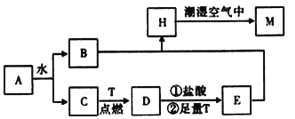
(1)物质D的化学式为 ________。
(2)A和水反应生成B和C的离子方程式为____________________,列出A的一种重要用途_________________。
(3)H在潮湿空气中变成M的实验现象是______________________。
(4)反应①的离子方程式为_______________________________________。
【答案】Fe3O4 2Na2O2 + 2H2O = 4Na++OH-+ O2↑ 供氧剂(或漂白剂) 白色絮状沉淀迅速变为灰绿色,最终变为红褐色 Fe3O4+8H+ =2Fe3++ Fe2++ 4H2O
【解析】
由已知D是具有磁性的黑色晶体,则D为Fe3O4;A为淡黄色固体,A与水反应生成B和C,所以A为Na2O2,C是无色无味的气体,C为O2,B为NaOH ,T为生活中使用最广泛的金属单质,T为Fe,H是白色沉淀,则H 为Fe(OH)2。
(1)根据上述分析可知物质D的化学式为Fe3O4;答案:Fe3O4。
(2)根据上述分析可知物质A为Na2O2,B为NaOH ,C为O2,A和水反应生成B和C的离子方程式为2Na2O2 + 2H2O = 4Na++OH-+ O2↑;A的一种重要用途为供氧剂(或漂白剂);答案:2Na2O2 + 2H2O = 4Na++OH-+ O2↑;供氧剂(或漂白剂)。
(3)H为Fe(OH)2,在空气中很不稳定,被氧气氧化,白色絮状沉淀迅速变为灰绿色,最终变为红褐色;答案:白色絮状沉淀迅速变为灰绿色,最终变为红褐色。
(4)反应①是Fe3O4与盐酸的反应,生成氯化铁和氯化亚铁、水,其离子方程式为Fe3O4+8H+ =2Fe3++ Fe2++ 4H2O;答案:Fe3O4+8H+ =2Fe3++ Fe2++ 4H2O。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.向硫酸铜溶液中加入铁片:3Cu2++2Fe=2Fe3++3Cu
B.石灰石与醋酸反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
C.碳酸氢铵与足量热的NaOH溶液反应:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-= BaSO3↓+SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下列图象中横坐标代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图象不能对应的是
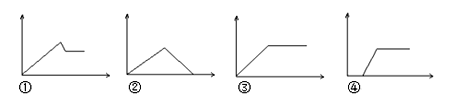
A.图①可能是MgCl2、AlCl3溶液逐滴加NaOH溶液至过量
B.图②可能是饱和石灰水中通CO2至过量
C.图③可能是NaAlO2溶液滴加稀盐酸至过量
D.图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

完成下列填空:
(1)写出烧瓶中生成SO2的化学方程式__。
(2)细铜丝表面的实验现象是__,使用细铜丝的原因是__。
(3)欲使反应停止,应进行的操作是__,反应一段时间以后,将烧瓶中液体冷却后,可观察到白色固体,推断该白色固体是__,理由是__。
(4)将Na2O2粉末沾在玻璃棉上的目的是__,若Na2O2与SO2完全反应,生成Na2SO3、O2和Na2SO4。为检验混合物中有Na2SO4,实验方案是__。
(5)实验装置中广口瓶的作用是__。在含0.1molNaOH的溶液中不断地通入SO2,得到溶质的质量为8.35g,则烧杯中生产的溶质是__。两者的物质的量之比为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com