
| A. | 氯原子的结构示意图: | |
| B. | 作为相对原子质量测定标准的碳核素:614C | |
| C. | CCl4的电子式 | |
| D. | 氯化镁的电子式: |
分析 A.氯原子的核电荷数、核外电子数都是17,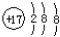 为氯离子结构示意图;
为氯离子结构示意图;
B.相对原子质量测定标准的碳核素的质量数为12;
C.四氯化碳的电子式中漏掉了氯原子的3对未成键电子对;
D.氯化镁为离子化合物,其电子式需要标出离子所带电荷,氯离子子需要标出最外层核外电子数.
解答 解:A.氯离子的核外电子数为17,氯离子的原子结构示意图为: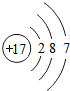 ,故A错误;
,故A错误;
B.作为相对原子质量测定标准的碳核素为碳-12,其正确的表示方法为:612C,故B错误;
C.CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4正确的电子式为 ,故C错误;
,故C错误;
D.氯化镁中存在阴阳离子,氯化镁的电子式为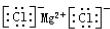 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及原子结构示意图、电子式、元素符号等知识,注意掌握离子化合物与共价化合物的电子式区别,明确常见化学用语的书写原则为解答关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | $\frac{1}{M}$g | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | $\frac{6.02×1{0}^{23}}{\;}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,M的化学式为FeS,F的电子式为
,M的化学式为FeS,F的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
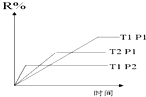
| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,c(Cl-)>c( NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com