
【题目】已知:①5Cl2+I2+6H2O=2HIO3+10HCl ②![]() +5Cl+6H+=3Cl2↑+3H2O
+5Cl+6H+=3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是 ( )
A. Cl2>![]() >
>![]() B.
B. ![]() >Cl2>
>Cl2>![]()
C. ![]() >
>![]() >Cl2 D. IO3->Cl2>ClO3-
>Cl2 D. IO3->Cl2>ClO3-
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】已知光气COCl2的分解反应为COCl2(g)Cl2(g)+CO(g)△H=+108kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 
①计算反应在地8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6)v(15﹣16)(填“<”、“>”或“=”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( ) 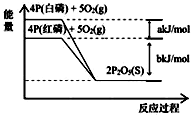
A.4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol
B.4P(红磷)+5O2(g)═2P2O5(S);△H2=﹣(b)kJ/mol
C.4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol
D.P(白磷)═P(红磷);△H4=+(a)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3NO2+H2O═2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为
(2)氧化剂与还原剂的质量比为 .
(3)在标准状况下,336mL NO2与H2O完全反应转移的电子数目为 , 若所得硝酸溶液体积为60mL,则该溶液的物质的量浓度为
(4)请配平以下化学方程式:FeSO4+HNO3(稀)﹣Fe2(SO4)3+Fe(NO3)3+NO↑+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用过滤的方法可以除去食盐水中的泥沙
B. 酒精灯加热烧瓶时不用垫石棉网
C. 氯化氢气体能使干燥的蓝色石蕊试纸变红
D. 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积约为10﹣12 , 将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va:Vb为( )
A.2:11
B.2:9
C.11:2
D.9:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com