
【题目】实验室分离或提纯下列各组物质时,应选用下列哪种主要仪器?(填字母)
![]()
![]()
![]()
(1)分离CCl4和H2O:_________;
(2)除去澄清石灰水中悬浮的CaCO3:_________;
(3)从含少量KNO3的NaCl溶液中提取NaCl:_________;
(4)分离乙酸(沸点为118℃)与乙酸乙酯(沸点为77.1℃)的混合物:_________。
科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,
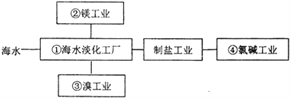
下列说法不正确的是
A. ①中可采用反渗透膜法,该法用到的半透膜可用于渗析操作
B. ②中工业上要制金属镁,可通过电解饱和氯化镁溶液的方法来获取
C. ③中提溴需要对含溴溶液加有机溶剂进行富集,该操作称为萃取
D. ④中氯碱工业电解饱和食盐水,采用的是阳离子交换膜法进行电解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7.下列关于滤液中的离子浓度关系不正确的是( )
A.![]() <1.0×10﹣7mol/L
<1.0×10﹣7mol/L
B.c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.c(H+)+c(NH4+)>c(OH﹣)+c(HCO3﹣)+2 c(CO32﹣)
D.c(Cl﹣)>c(HCO3﹣)>c(NH4+)>c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若c(K+)为0.15 mol/L,c(Fe3+)为0.25 mol/L ,c(Cl-)为0.2 mol/L ,则c(SO42-)为
A. 0.1 mol/L B. 0.15 mol/L
C. 0.25 mol/L D. 0.35 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为

A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氮,通过下列实验测定其浓度
①取水样10.0mL于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2﹣3滴.
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01molL﹣1的Na2S2O3溶液,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6 .
试回答下列问题:
(1)步骤①加入的指示剂是 .
(2)步骤②应使用式滴定管.
(3)试描述滴定终点的现象: .
(4)若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 .
(5)请指出实验中的一处明显错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
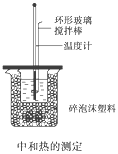
(1)烧杯间填满碎泡沫塑料的作用是_________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由_________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气,放出484 kJ热量,下列热化学方程式正确的是( )
A. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C.下列说法正确的是( )
A.14C和14N互为同位素
B.14C和C60是同素异形体
C.![]() C核素中的中子数为8
C核素中的中子数为8
D.14CO2的摩尔质量为46
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com