
【题目】下图是研究铜与浓硫酸的反应装置:
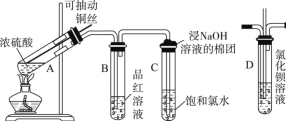
(1)A试管中发生反应的化学方程式为__________
(2)反应一段时间后,可观察到B试管中的现象为___________________
(3)C试管口浸有NaOH溶液的棉团作用是_________________
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是__________、__________。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是___________
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 溶液由红色变成无色 吸收Cl2和SO2防止污染空气 NH3(NO2或ClO2) Cl2(O3或O2或Br2蒸汽) 向上拉铜丝终止反应,冷却后将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色
CuSO4+SO2↑+2H2O 溶液由红色变成无色 吸收Cl2和SO2防止污染空气 NH3(NO2或ClO2) Cl2(O3或O2或Br2蒸汽) 向上拉铜丝终止反应,冷却后将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色
【解析】
根据装置分析可知,装置A中浓硫酸与Cu加热制取SO2,B为检验SO2的漂白性的装置,C为尾气处理装置,若向D装置中通入SO2,要生成白色沉淀,需要加入强氧化剂将BaSO3氧化为BaSO4,据此分析解答。
(1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)由于反应产生了SO2气体;该气体由漂白性,能使品红溶液褪色。因此反应一段时间后,可观察到B试管中品红溶液由红色变为无色,故答案为:溶液由红色变成无色;
(3)Cl2、SO2气体容易导致大气污染,因为SO2和Cl2气体均能与碱液反应,所以在C试管口用浸有NaOH溶液的棉团来吸收扩散的SO2和Cl2气体,故答案为:吸收Cl2和SO2防止污染空气;
(4)向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,故答案为:NH3;Cl2 ;
(5)实验结束后,若要证明A试管中反应所得产物含有铜离子,操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色,故答案为:向上拉铜丝终止反应,冷却后将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色。


科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大且原子序数均不超过20,W、X同周期,W、Z的原子序数之和为28,它们组成的化合物![]() 是一种制造磷肥的原料。下列说法错误的是( )
是一种制造磷肥的原料。下列说法错误的是( )
A.非金属性:![]() B.
B.![]() 中不含共价键
中不含共价键
C.原子半径:![]() D.
D.![]() 分子中各原子最外层均达到8电子结构
分子中各原子最外层均达到8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在容积不变的密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A.2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.混合气体的密度不再改变的状态为平衡状态
C.前2min A的分解速率为0.1molL-1min-1
D.达平衡后,若减小压强,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_____(填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是_____(填代号)
a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-=2
+2I-=2![]() +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程___、___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(s)![]() pC(g)+qD( g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是
pC(g)+qD( g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是
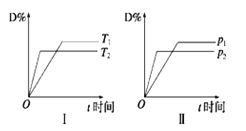
A.化学方程式中化学计量数:p+q> m+n
B.降温可使化学平衡向正反应方向移动
C.使用合适的催化剂可使D%有所增加
D.加入少量的B,正反应速率加快,有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com