
 和
和 表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
 ,D为S元素,第三周期第Ⅳ族,其价电子排布式为3s23p4,
,D为S元素,第三周期第Ⅳ族,其价电子排布式为3s23p4, ;3s23p4;
;3s23p4;

科目:高中化学 来源: 题型:
 Ⅰ.下列有关操作正确的是
Ⅰ.下列有关操作正确的是| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 +CaCl2+H2O
+CaCl2+H2O| Ag |

查看答案和解析>>
科目:高中化学 来源: 题型:
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. |
其产量用来衡量一个国家的石油化工水平. | 比例模型为: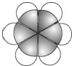 |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. |
由5个原子组成的10个电子的共价分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Cu2+、Cl-、SO42- |
| B、ClO-、Na+、H+、Cl- |
| C、Fe3+、H+、SO42-、I- |
| D、Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com