
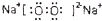 ,
,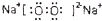 ;
;
| ||
| ||


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、Ca2+、Al3+、CO32-、Cl- |
| B、Cu2+、NO3-、H+、Cl- |
| C、Na+、OH-、SO42-、HCO3- |
| D、K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )发生化
)发生化查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源B极是正极 |
| B、(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
| C、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
| D、装置(丁)中X极附近红褐色不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com