


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. |
其产量用来衡量一个国家的石油化工水平. | 比例模型为: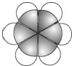 |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. |
由5个原子组成的10个电子的共价分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、SO2(g)+
| ||
| B、2SO2(g)+O2(g)?2SO3(g);△H=-196.6KJ?mol-1 | ||
C、SO2(g)+
| ||
| D、2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的分解速率与Y的消耗速率相等 |
| B、X、Y、Z的物质的量比为2:1:1 |
| C、混合气体的密度不再变化 |
| D、单位时间内生成lmolY的同时分解2mol X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com