
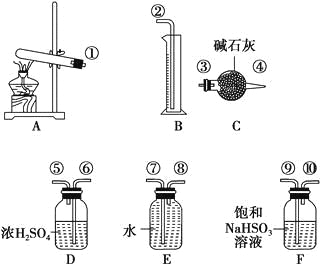
【题目】硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有_______两种;
Ⅲ.所得气体的成分可能含有_______三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→_______→_______→_______→_______→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想_______正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:_______________________________________________________;
第二小组:_______________________________________________________。
【答案】SO2、O2 SO2、SO3、O2 ③ ④ ⑧ ⑦ Ⅰ 2CuSO4![]() 2CuO+2SO2↑+O2↑ 4CuSO4
2CuO+2SO2↑+O2↑ 4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】
【提出猜想】
猜想Ⅱ.如果有氧气生成,则发生的化学反应是氧化还原反应,则生成的另一种气体应该是SO2;
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2;
(1)实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序;
(2)若实验结束时装置B中量筒没有收集到水,说明生成的气体完全被吸收;
(3)c装置吸收的是SO2,E装置中收集的气体是O2,根据转移电子配平方程式,
实验一中n(CuSO4)=![]() =0.04mol,n(SO2)=
=0.04mol,n(SO2)=![]() =0.04mol、n(O2)=
=0.04mol、n(O2)=![]() =0.02mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=
=0.02mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=![]() =0.04mol,所以该反应中没有SO3生成,
=0.04mol,所以该反应中没有SO3生成,
实验二中n(CuSO4)=![]() =0.04mol,n(SO2)=
=0.04mol,n(SO2)=![]() =0.06mol,n(O2)=
=0.06mol,n(O2)=![]() =0.01mol,
=0.01mol,
根据转移电子守恒知,硫酸铜分解生成n(SO2)=![]() =0.02mol<0.06mol,所以生成的气体中含有SO3。
=0.02mol<0.06mol,所以生成的气体中含有SO3。
试题【提出猜想】
猜想Ⅱ.如果有氧气生成,则发生的化学反应中有电子转移,所以是氧化还原反应,则生成的另一种气体应该是SO2,因为硫酸和SO3中S元素化合价相同,所以只能是SO2;猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,故答案为SO2、O2;SO3、SO2、O2;
(1)实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序,A是制取气体、B是量取生成氧气体积、C是吸收二氧化硫、D是干燥氧气、E是排水法收集氧气、F吸收三氧化硫,其实验先后顺序是制取气体、除去三氧化硫、吸收水分、吸收二氧化硫、吸收二氧化硫、干燥氧气、收集氧气,所以其排列顺序为①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②,故答案为③;④;⑧;⑦;
(2)若实验结束时装置B中量筒没有收集到水,说明生成的气体完全被吸收,因为生成二氧化硫时一定生成氧气,氧气不能被吸收,所以生成的气体只能是三氧化硫,所以I是正确的,故选I;
(3)c装置吸收的是SO2,E装置中收集的气体是O2,实验一中n(CuSO4)=![]() =0.04mol,n(SO2)=
=0.04mol,n(SO2)=![]() =0.04mol、n(O2)=
=0.04mol、n(O2)=![]() =0.02mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=
=0.02mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=![]() =0.04mol,所以该反应中没有SO3生成,再结合原子守恒配平方程式为2CuSO4
=0.04mol,所以该反应中没有SO3生成,再结合原子守恒配平方程式为2CuSO4![]() 2CuO+2SO2↑+O2↑;
2CuO+2SO2↑+O2↑;
实验二中n(CuSO4)=![]() =0.04mol,n(SO2)=
=0.04mol,n(SO2)=![]() =0.06mol,n(O2)=
=0.06mol,n(O2)=![]() =0.01mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=
=0.01mol,根据转移电子守恒知,硫酸铜分解生成n(SO2)=![]() =0.02mol<0.06mol,所以生成的气体中含有SO3,根据SO3+2NaHSO3=Na2SO4+2SO2+H2O知,生成n(SO3)=
=0.02mol<0.06mol,所以生成的气体中含有SO3,根据SO3+2NaHSO3=Na2SO4+2SO2+H2O知,生成n(SO3)=![]() ×1=0.02mol,所以n(SO2):n(SO3):n(O2)=0.02mol:0.02mol:0.01mol=2:2:1,根据原子守恒配平方程式得4CuSO4
×1=0.02mol,所以n(SO2):n(SO3):n(O2)=0.02mol:0.02mol:0.01mol=2:2:1,根据原子守恒配平方程式得4CuSO4![]() 4CuO+2SO2↑+2SO3↑+O2↑,故答案为2CuSO4
4CuO+2SO2↑+2SO3↑+O2↑,故答案为2CuSO4![]() 2CuO+2SO2↑+O2↑;4CuSO4
2CuO+2SO2↑+O2↑;4CuSO4![]() 4CuO+2SO2↑+2SO3↑+O2↑。
4CuO+2SO2↑+2SO3↑+O2↑。
【点晴】
本题考查性质实验方案设计,侧重考查学生实验操作、分析问题、解答问题能力,明确实验原理是解本题关键,知道实验仪器连接顺序,知道各个仪器中试剂的作用。本题的易错点和难点是氧化还原反应方程式的书写。


科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
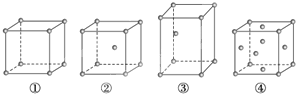
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞的结构简式如图,下列关于酚酞的说法一定正确的是
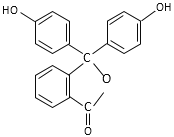
A. 酚酞的分子式是C20H12O4
B. 分子中的碳原子不在同一平面
C. 1 mol酚酞最多可消耗2 mol NaOH
D. 常温下,由水电离的c(H+)=10-13mol·L-1的溶液中滴入酚酞试液后,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
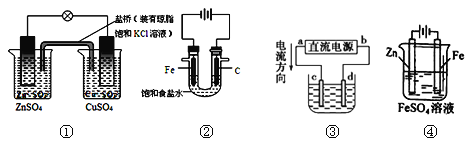
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下列实验:
实验1:
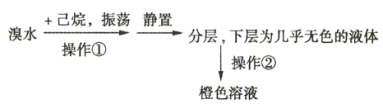
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
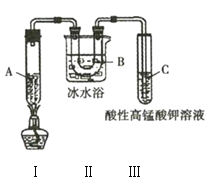
实验3:利用如图所示实验装置在一定条件分解己烷(生成丙烷和丙烯![]() ),且丙烯能被酸性
),且丙烯能被酸性![]() 溶液氧化。
溶液氧化。
(1)实验1中用到的玻璃仪器主要有______________________________________(填名称)。
(2)由实验1可知,己烷的物理性质有____________________________________。
(3)实验2中的橙色溶液逐渐变浅的原因是__________________(填序号)。
A.己烷与溴发生了取代反应
B.溴代己烷为无色物质
C.液溴向外挥发浓度降低
D.己烷与液溴发生了加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3中装置Ⅱ的作用是______________________________________。
(5)试管C中的现象是______________________________________。
(6)试写出装置Ⅰ中发生的生成丙烷和丙烯的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05gcm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
I.制备粗产品:如图所示装置中,于50ml圆底烧瓶中加入8.0g苯甲酸(Mr=122)、20ml乙醇(Mr=46,密度0.79gcm-3)、15ml环己烷、3ml浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
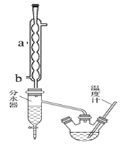
粗产品纯化:加水30ml,分批加入固体NaHCO3,分液,然后水层用20ml石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213℃馏分。
相关数据如下:
沸点(℃,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物 |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式_____________________________________,
仪器a的名称______________,冷凝水的进水口为______(填a或b)。
(2)在本实验中可以提高苯甲酸乙酯产率的方法有:_________________________________。
A.加入环已烷形成水![]() 乙醇
乙醇![]() 环已烷三元共沸物分离出反应过程中生成的水
环已烷三元共沸物分离出反应过程中生成的水
B.加过量的乙醇
C.使用分水器及时分离出生成的水
(3)如何利用实验现象判断反应已基本完成_____________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3后实验操作分液所用到的主要玻璃仪器为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com