
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

Ⅰ.制取SO2
(1)写出烧瓶中生成SO2的化学方程式:_______________________。
(2)写出实验现象:
①细铜丝表面:_______________________________________。
②实验过程中,烧瓶内液体始终保持澄清,并_______________________________。
(3)欲使反应停止,应进行的操作是:______________________________________。
烧瓶中液体冷却后,可观察到的现象是:___________________________________。
Ⅱ.探究SO2与Na2O2反应后的固体产物。
(4)实验方案如下:取洗涤玻璃棉所得溶液,________________________________
(5)把Na2O2粉末散附在玻璃棉上的目的是:__________________________________。
若Na2O2未完全反应,对实验结果的影响是(用必要的文字和化学方程式表示)_______________________________________________________________________
III.装置改进
(6)老师指出该实验装置需做如下改进(只答出一种即可):
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
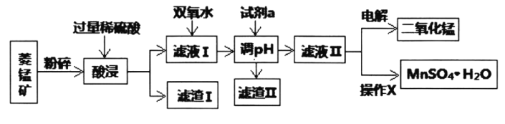
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
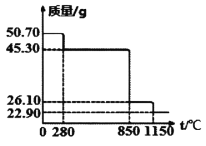
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO沉淀质量,以确定碳酸钙的质量分数。
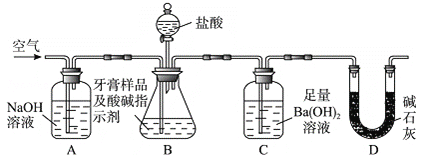
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________。
(4)C中反应生成沉淀的离子方程式是______________________________。
(5)下列各项措施中,不能提高测定准确度的是____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
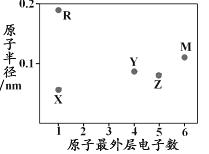
A. R的氧化物含有离子键 B. 最高价含氧酸的酸性:Z<Y
C. M的氢化物常温常压下为气体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
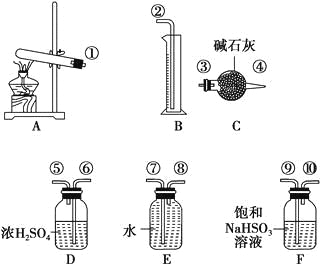
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有_______两种;
Ⅲ.所得气体的成分可能含有_______三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→_______→_______→_______→_______→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想_______正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:_______________________________________________________;
第二小组:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的制碱工艺,发明了著名的联合制碱法,其生产流程如下图所示。请根据工艺流程,回答下列问题。

![]() 沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________
沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________![]() 填化学式
填化学式![]() ,再通入________
,再通入________![]() 填化学式
填化学式![]() ,使得固体B结晶析出。
,使得固体B结晶析出。
![]() 请设计实验检验固体产品C中是否含有氯化钠。
请设计实验检验固体产品C中是否含有氯化钠。![]() 默认产品中的阳离子均为钠离子
默认产品中的阳离子均为钠离子![]() _________。
_________。
![]() 向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
![]() 煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为
煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为![]() ,则产品中物质C的质量分数为________。
,则产品中物质C的质量分数为________。
![]() 将提纯后纯净的物质B与
将提纯后纯净的物质B与![]() 以
以![]() 物质的量之比
物质的量之比![]() 混合,置于一密闭容器内共热
混合,置于一密闭容器内共热![]() 加热前容器内只含有固体混合物和氮气
加热前容器内只含有固体混合物和氮气![]() 。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____
。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____![]() 填化学式
填化学式![]() ,次要成分是________
,次要成分是________![]() 填化学式
填化学式![]() ,主要成分与次要成分的物质的量之比为________。
,主要成分与次要成分的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
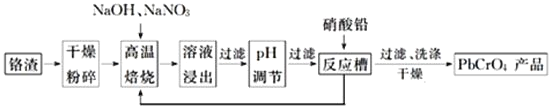
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com