
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
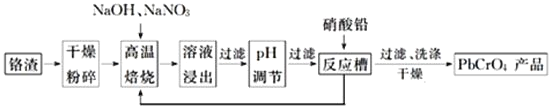
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
【答案】+6 ![]() 提高铬渣焙烧的速率和转化率 6:5
提高铬渣焙烧的速率和转化率 6:5 ![]() 硝酸
硝酸 ![]()
![]()
【解析】
(1)根据在化合物中正负化合价代数和为零,计算铬元素的化合价;
(2)根据反应![]() ,可计算出平衡常数;
,可计算出平衡常数;
(3)干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
(1)铅元素的化合价为![]() 价,氧元素显
价,氧元素显![]() 价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+4×(-2)=0,则x=+6价;
价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+4×(-2)=0,则x=+6价;
(2)![]() 的平衡常数
的平衡常数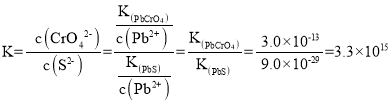 ;
;
(3)干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品;
10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品;
①铬渣高温焙烧前粉碎的目的是提高铬渣焙烧的速率和转化率;
②高温焙烧得到的产物含有![]() 和一种无污染的气体,5Cr2O3+14NaOH+6NaNO3
和一种无污染的气体,5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,则氧化剂和还原剂物质的量之比为6:5;
10Na2CrO4+3N2↑+7H2O,则氧化剂和还原剂物质的量之比为6:5;
③高温焙烧时![]() 与氢氧化钠反应生成硅酸钠和水,反应的化学方程式为
与氢氧化钠反应生成硅酸钠和水,反应的化学方程式为![]() ;
;
④除去浸出液中的杂质最好加入硝酸来调节pH;硝酸与偏铝酸钠反应生成氢氧化铝,除去铝元素的离子方程式为![]() ;
;
⑤据原子守恒:

![]() ,
,
则铬渣中![]() 的质量分数是
的质量分数是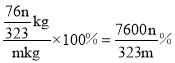 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B. 实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C. 用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D. 在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为![]() ,则生成1mol水放出的热量为
,则生成1mol水放出的热量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
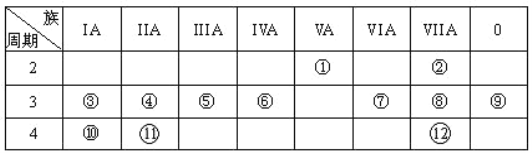
(1)写出①原子结构示意图_______________
(2)在这些元素中,金属性最强的元素是_______,(填元素符号)元素⑦与元素⑧相比,非金属性较强的是 _____________(填元素符号)
(3)⑤的最高价氧化物对应水化物与⑧的最高价氧化物对应水化物反应的离子方程式为:________________
(4)⑤的单质与③的最高价氧化物对应水化物反应的离子方程式为___________________________
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑦形成一种AB2型的化合物,请用电子式表示其形成过程:_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室制取少量乙酸乙酯的装置。下列关于该实验的叙述不正确的是( )
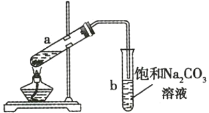
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防止实验过程中发生倒吸
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和![]() 溶液的作用之一是吸收乙酸乙酯
溶液的作用之一是吸收乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、
、![]() 、
、![]()
C.0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、![]()
D.0.1mol·L-1NaOH溶液:Mg2+、Na+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是一种常用香料的主要成分之一,其合成路线如下。
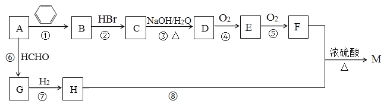
已知:
①相同条件下1体积烃A完全燃烧消耗4体积氧气;
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
③反应①的原子利用率为100%,反应类型属于加成反应;
④M的分子式为C13H18O2。
回答下列问题:
(1)A的名称为___________;G分子中有___ _个碳原子在同一条直线上。
(2)反应②~⑧中属于加成反应的是______;H中官能团的名称为___________。
(3)物质M的结构简式为____________。B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为_____________。
(4)反应③的化学反应方程式为_______________。
(5)符合下列条件的F的同分异构体共有_____种。
①能发生银镜反应;②能发生水解反应;③属于芳香族化合物。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (任写一种物质的结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com