
【题目】下列说法正确的是( )
A. 准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B. 实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C. 用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D. 在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为![]() ,则生成1mol水放出的热量为
,则生成1mol水放出的热量为![]()
科目:高中化学 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
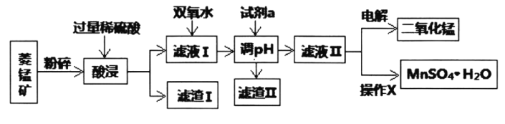
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
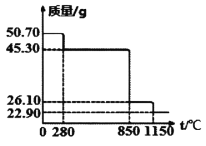
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的制碱工艺,发明了著名的联合制碱法,其生产流程如下图所示。请根据工艺流程,回答下列问题。

![]() 沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________
沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________![]() 填化学式
填化学式![]() ,再通入________
,再通入________![]() 填化学式
填化学式![]() ,使得固体B结晶析出。
,使得固体B结晶析出。
![]() 请设计实验检验固体产品C中是否含有氯化钠。
请设计实验检验固体产品C中是否含有氯化钠。![]() 默认产品中的阳离子均为钠离子
默认产品中的阳离子均为钠离子![]() _________。
_________。
![]() 向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
![]() 煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为
煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为![]() ,则产品中物质C的质量分数为________。
,则产品中物质C的质量分数为________。
![]() 将提纯后纯净的物质B与
将提纯后纯净的物质B与![]() 以
以![]() 物质的量之比
物质的量之比![]() 混合,置于一密闭容器内共热
混合,置于一密闭容器内共热![]() 加热前容器内只含有固体混合物和氮气
加热前容器内只含有固体混合物和氮气![]() 。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____
。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____![]() 填化学式
填化学式![]() ,次要成分是________
,次要成分是________![]() 填化学式
填化学式![]() ,主要成分与次要成分的物质的量之比为________。
,主要成分与次要成分的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
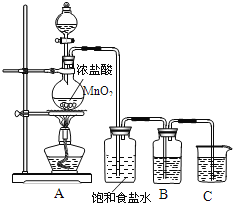
(1)盛装MnO2的仪器名称:_____
(2)实验室制氯气的反应原理为:__HCl(浓)+__MnO2 =加热=__MnCl2+__Cl2↑+__H2O(请将方程式中反应系数补充完整)
(3)盛有饱和食盐水的洗气瓶的作用是______.
(4)装置B中盛放的试剂是______(填选项),实验现象为______.
a.Na2S溶液b.Na2SO3溶液c.Na2SO4溶液
(5)装置C中盛放烧碱稀溶液,目的是______.
(6)能证明氯元素比硫元素非金属性强的依据为______.(填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2-比Cl-还原性强;
④HCl比H2S稳定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
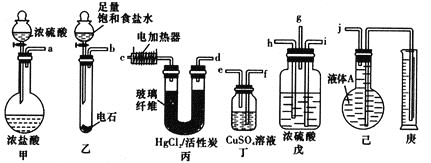
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
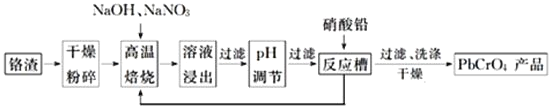
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com