
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
【答案】B
【解析】
其工艺流程可表示为淀粉水解生成麦芽糖,麦芽糖水解生成葡萄糖,葡萄糖发酵生成酒精;
A. 蔗糖和麦芽糖的化学式都是C12H22O11;
B. 根据C6H12O6 ![]() 2C2H5OH+2CO2↑分析;
2C2H5OH+2CO2↑分析;
C. 淀粉遇碘变蓝;
D. 用蒸馏分离互溶的沸点不同的液体。
A. C12H22O11属于二糖,可能为蔗糖和麦芽糖,故A项正确;
B. C6H12O6 ![]() 2C2H5OH+2CO2↑,1mol葡萄糖分解成2mol乙醇,故B项错误;
2C2H5OH+2CO2↑,1mol葡萄糖分解成2mol乙醇,故B项错误;
C. 取少许水解液于试管中,若滴加碘水,无明显变化,则证明淀粉已水解完全,即可用碘水检验淀粉是否完全水解,故C项正确;
D. 酒精和水互溶,且两者沸点不同,可用蒸馏分馏,故D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.涤纶属于合成纤维
B.用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C.石油的分馏、煤的液化和气化、煤的干馏都是物理变化,石油的裂化、裂解都是化学变化
D.制取环氧乙烷:2CH2=CH2+O2![]() 2
2![]() ,符合绿色化学的理念
,符合绿色化学的理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 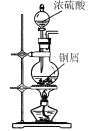 制备SO2
制备SO2
B. 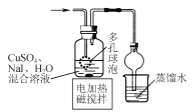 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 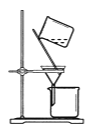 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 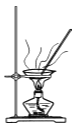 加热干燥湿的CuI固体
加热干燥湿的CuI固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学名称:A:_________I:_________J:_________G:_________
(2)写出C→I的离子方程式:_____________________________________________________。
(3)写出F→G实验现象:_________________________________________________________。
(4)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:

①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全存储与运输有机化合物,避免造成污染是重要的社会责任。C-9芳烃主要指催化重整和裂解制乙烯副产物中的含九个碳原子的芳香烃,沸点在153℃左右。下列说法不正确的是
A. 得到C-9芳烃的过程中发生了化学变化
B. ![]() 是C-9芳烃的组分之一
是C-9芳烃的组分之一
C. C-9芳烃常温下为液态,密度比水小
D. 运输C-9芳烃的车辆所贴的危险化学品标志是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯夫拉纤维是生产防弹衣的主要材料之一,其结构片段如下:

下列说法不正确的是
A. 其结构简式为:![]()
B. 凯夫拉纤维在发生水解反应的过程中,![]() 中的C—N键断裂
中的C—N键断裂
C. 完全水解产物的单个分子中,苯环上的氢原子具有相同的化学环境
D. 通过质谱法测定凯夫拉纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________,具有___________(填“还原性”或“氧化性”)
(2)Fe2O3可处理产生的Na,反应为![]() ,反应中Na做____________(填“还原剂”或“氧化剂”)。
,反应中Na做____________(填“还原剂”或“氧化剂”)。
(3) NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则,(1)反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=____________。
2Fe(s)+3CO2(g) △H=____________。
(2)反应 ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡,则CO的平衡转化率=____________。
Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡,则CO的平衡转化率=____________。
II.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:


(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= _________,CO(g)+2H2(g)![]() CH3OH(g) △H=___________。
CH3OH(g) △H=___________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:

则下列关系正确的是 ____________。
A. c1=c2 B.2Q1=Q3 C. 2a1=a3
D.a1+a2 =1 E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________ (填“正”、“逆”)反应方向移动。
III.在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的物质的量分别如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x mol,当x在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围______________________。
(3)若要使右室反应开始时V正<V逆,x的取值范围________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com