
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________,具有___________(填“还原性”或“氧化性”)
(2)Fe2O3可处理产生的Na,反应为![]() ,反应中Na做____________(填“还原剂”或“氧化剂”)。
,反应中Na做____________(填“还原剂”或“氧化剂”)。
(3) NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为____________。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是____________________。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________。
(4)己知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子式为C4H10O的有机化合物一定是饱和一元醇
B.1molCl2通入足量水充分反应后转移的电子数为6.02×1023
C.H2O2具有氧化性,该性质可用于与酸性高锰酸钾溶液反应制取少量氧气
D.已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l) △H=+Q1 kJmol-1.室温下,若1mol无水硫酸铜溶解为溶液放热Q2 kJ,则Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如下转化,下列有关上述转化关系中物质及其反应的叙述不正确的是

A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(/mol/L) | 0.010 | 0.010 | 0.020 |
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
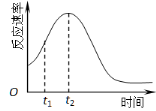 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com