
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、
、![]() 、
、![]()
C.0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、![]()
D.0.1mol·L-1NaOH溶液:Mg2+、Na+、![]() 、
、![]()
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的制碱工艺,发明了著名的联合制碱法,其生产流程如下图所示。请根据工艺流程,回答下列问题。

![]() 沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________
沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________![]() 填化学式
填化学式![]() ,再通入________
,再通入________![]() 填化学式
填化学式![]() ,使得固体B结晶析出。
,使得固体B结晶析出。
![]() 请设计实验检验固体产品C中是否含有氯化钠。
请设计实验检验固体产品C中是否含有氯化钠。![]() 默认产品中的阳离子均为钠离子
默认产品中的阳离子均为钠离子![]() _________。
_________。
![]() 向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
![]() 煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为
煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为![]() ,则产品中物质C的质量分数为________。
,则产品中物质C的质量分数为________。
![]() 将提纯后纯净的物质B与
将提纯后纯净的物质B与![]() 以
以![]() 物质的量之比
物质的量之比![]() 混合,置于一密闭容器内共热
混合,置于一密闭容器内共热![]() 加热前容器内只含有固体混合物和氮气
加热前容器内只含有固体混合物和氮气![]() 。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____
。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____![]() 填化学式
填化学式![]() ,次要成分是________
,次要成分是________![]() 填化学式
填化学式![]() ,主要成分与次要成分的物质的量之比为________。
,主要成分与次要成分的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
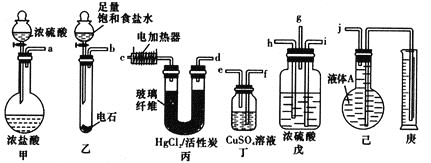
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
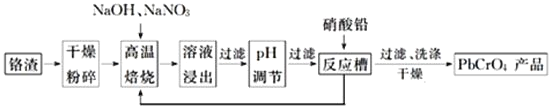
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是
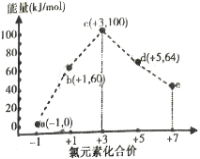
A.e是ClO3-
B.a,b,c,d,e中c最稳定
C.b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-116kJmol-1
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为10:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
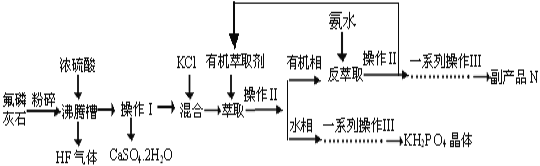
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.已知:![]()
![]() ,由此可知
,由此可知![]() 气体在密闭容器中分解后可以放出
气体在密闭容器中分解后可以放出![]() 的热量
的热量
B.已知:![]()
![]() ,则氢气的燃烧热
,则氢气的燃烧热![]()
C.肼![]() 是一种用于制造火箭燃料或燃料电池的原料,已知
是一种用于制造火箭燃料或燃料电池的原料,已知![]()
![]()
![]() ;
;![]()
![]()
![]() ,则有反应:
,则有反应:![]()
![]()
D.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为
的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.60 |
回答下列问题:
(1)实验中,需要润洗的仪器是:________________________(填写仪器名称)。
(2)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是______________
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则消耗盐酸溶液的体积为________mL。
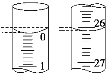
(4)下列操作中会使所测结果偏高的是_________________、偏低的是_________________
①酸式滴定管漏液;②滴定前酸式滴定管尖嘴部分有气泡,滴定过程中气泡变小;③滴定过程中,振荡锥形瓶时,不小心将溶液溅出;④滴定过程中,锥形瓶内加少量蒸馏水; ⑤用甲基橙作指示剂进行滴定时,溶液由橙色变红色时停止滴定;⑥用甲基橙作指示剂,溶液由黄色变橙色,5 s后又变为黄色。⑦读酸式滴定管读数时,滴定前仰视读数
(5)未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com