
【题目】下列说法正确的是
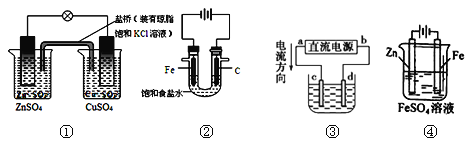
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁![]() 是重要的无机化工产品。一种由白云石
是重要的无机化工产品。一种由白云石![]() 主要成分为
主要成分为![]() ,还含少量
,还含少量![]() 、
、![]() 等
等![]() 为原料制备碱式碳酸镁
为原料制备碱式碳酸镁![]() 国家标准中CaO的质量分数
国家标准中CaO的质量分数![]()
![]() 的实验流程如下:
的实验流程如下:

![]() “煅烧”时发生主要反应的化学方程式为________________。
“煅烧”时发生主要反应的化学方程式为________________。
![]() 常温常压下“碳化”可使镁元素转化为
常温常压下“碳化”可使镁元素转化为![]() ,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
图1 CaO含量与碳化终点pH的关系
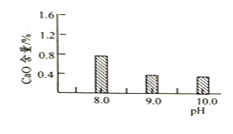
图2碱式碳酸镁产率与碳化终点pH的关系
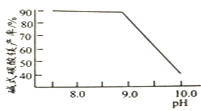
![]() 应控制“碳化”终点PH约为__________。
应控制“碳化”终点PH约为__________。
![]() 图
图![]() 中,当
中,当![]()
![]() 时,镁元素的主要存在形式是__________________
时,镁元素的主要存在形式是__________________![]() 写化学式
写化学式![]() 。
。
![]() “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
![]() 一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
![]() 称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体![]() 标准状况
标准状况![]() ;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体![]() 。
。
![]() 另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率![]() 固体样品的剩余质量
固体样品的剩余质量![]() 固体样品的起始质量
固体样品的起始质量![]() 随温度的变化如下图所示
随温度的变化如下图所示![]() 样品在
样品在![]() 时完全失去结晶水
时完全失去结晶水![]() 。
。
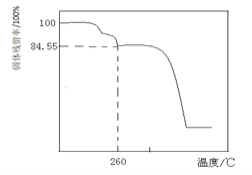
根据以上实验数据计算确定碱式碳酸镁晶体的化学式![]() 写出计算过程
写出计算过程![]() _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
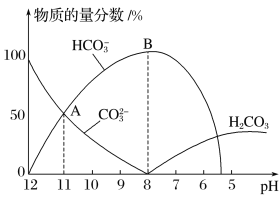
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO沉淀质量,以确定碳酸钙的质量分数。
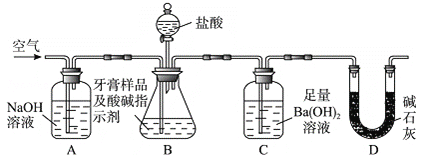
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________。
(4)C中反应生成沉淀的离子方程式是______________________________。
(5)下列各项措施中,不能提高测定准确度的是____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H![]() B在水中的电离方程式是
B在水中的电离方程式是![]() 、HB
、HB![]() H
H![]() 。
。
![]() 的NaHB溶液显酸性,原因是________________________________。
的NaHB溶液显酸性,原因是________________________________。
![]() 在
在![]() 的Na2B溶液中,下列粒子浓度关系式正确的是________
的Na2B溶液中,下列粒子浓度关系式正确的是________![]() 填标号
填标号![]() 。
。
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
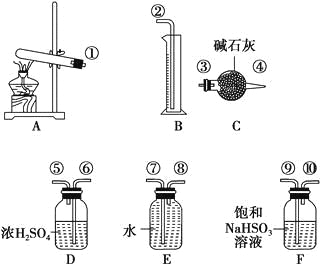
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有_______两种;
Ⅲ.所得气体的成分可能含有_______三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→_______→_______→_______→_______→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想_______正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:_______________________________________________________;
第二小组:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A. 电子由电极A经外电路流向电极B
B. 该电池工作时,每消耗22.4L NH3转移3mol电子
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用![]() 的盐酸与
的盐酸与![]() 的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法错误的是
的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法错误的是
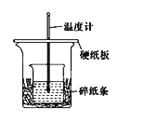
A.如图条件下实验过程中有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用![]() 的NaOH溶液进行反应,所放出热量相等
的NaOH溶液进行反应,所放出热量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com