
【题目】某实验小组学生用![]() 的盐酸与
的盐酸与![]() 的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法错误的是
的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法错误的是
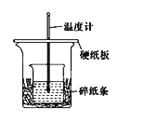
A.如图条件下实验过程中有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用![]() 的NaOH溶液进行反应,所放出热量相等
的NaOH溶液进行反应,所放出热量相等
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
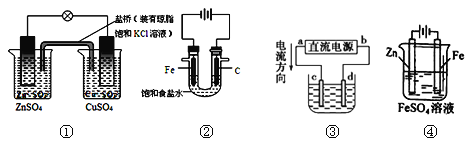
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05gcm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
I.制备粗产品:如图所示装置中,于50ml圆底烧瓶中加入8.0g苯甲酸(Mr=122)、20ml乙醇(Mr=46,密度0.79gcm-3)、15ml环己烷、3ml浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
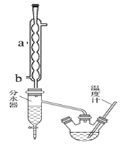
粗产品纯化:加水30ml,分批加入固体NaHCO3,分液,然后水层用20ml石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213℃馏分。
相关数据如下:
沸点(℃,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物 |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式_____________________________________,
仪器a的名称______________,冷凝水的进水口为______(填a或b)。
(2)在本实验中可以提高苯甲酸乙酯产率的方法有:_________________________________。
A.加入环已烷形成水![]() 乙醇
乙醇![]() 环已烷三元共沸物分离出反应过程中生成的水
环已烷三元共沸物分离出反应过程中生成的水
B.加过量的乙醇
C.使用分水器及时分离出生成的水
(3)如何利用实验现象判断反应已基本完成_____________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3后实验操作分液所用到的主要玻璃仪器为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________,核外电子占据最高能层符号为________。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______键相结合,氮化镓属于_______晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________。
②反应物AsH3分子的几何构型为_______,(CH3)3Ga中镓原子杂化方式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
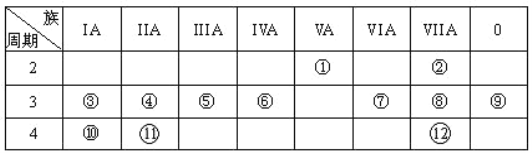
(1)写出①原子结构示意图_______________
(2)在这些元素中,金属性最强的元素是_______,(填元素符号)元素⑦与元素⑧相比,非金属性较强的是 _____________(填元素符号)
(3)⑤的最高价氧化物对应水化物与⑧的最高价氧化物对应水化物反应的离子方程式为:________________
(4)⑤的单质与③的最高价氧化物对应水化物反应的离子方程式为___________________________
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑦形成一种AB2型的化合物,请用电子式表示其形成过程:_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示物质是一种重要的化工原料。下列有关该有机化合物的叙述正确的是( )
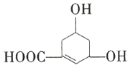
A.该有机化合物的分子式为![]()
B.能使溴的![]() 溶液、酸性
溶液、酸性![]() 溶液褪色
溶液褪色
C.能发生酯化反应
D.具有相同种类和数量的官能团的结构共有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
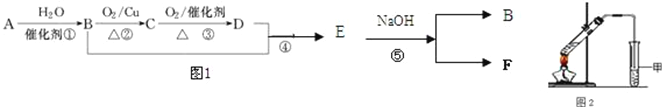
(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
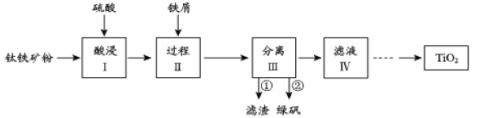
已知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式:_____________________。
(2)过程II中加入适量铁屑的目的是_____________________________。
(3)分离III中步骤②得到绿矾的操作是__________________________。
(4)由滤液IV提取TiO2的过程如下:
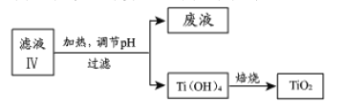
①请用化学平衡移动原理解释滤液加热煮沸的目的:_______________。
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于______℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -26.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com