
【题目】碱式碳酸镁![]() 是重要的无机化工产品。一种由白云石
是重要的无机化工产品。一种由白云石![]() 主要成分为
主要成分为![]() ,还含少量
,还含少量![]() 、
、![]() 等
等![]() 为原料制备碱式碳酸镁
为原料制备碱式碳酸镁![]() 国家标准中CaO的质量分数
国家标准中CaO的质量分数![]()
![]() 的实验流程如下:
的实验流程如下:

![]() “煅烧”时发生主要反应的化学方程式为________________。
“煅烧”时发生主要反应的化学方程式为________________。
![]() 常温常压下“碳化”可使镁元素转化为
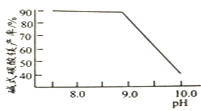
常温常压下“碳化”可使镁元素转化为![]() ,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
图1 CaO含量与碳化终点pH的关系
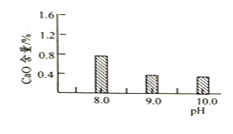
图2碱式碳酸镁产率与碳化终点pH的关系
![]() 应控制“碳化”终点PH约为__________。
应控制“碳化”终点PH约为__________。
![]() 图
图![]() 中,当
中,当![]()
![]() 时,镁元素的主要存在形式是__________________
时,镁元素的主要存在形式是__________________![]() 写化学式
写化学式![]() 。
。
![]() “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
![]() 一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
![]() 称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体![]() 标准状况
标准状况![]() ;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体![]() 。
。
![]() 另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率![]() 固体样品的剩余质量
固体样品的剩余质量![]() 固体样品的起始质量
固体样品的起始质量![]() 随温度的变化如下图所示
随温度的变化如下图所示![]() 样品在
样品在![]() 时完全失去结晶水
时完全失去结晶水![]() 。
。
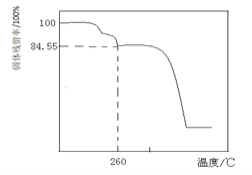
根据以上实验数据计算确定碱式碳酸镁晶体的化学式![]() 写出计算过程
写出计算过程![]() _________。
_________。
【答案】![]()
![]()
![]() 9.0
9.0 ![]() 漏斗
漏斗 ![]()
【解析】
白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]在高温下焙烧,其中CaMg(CO3)2分解生成CaO、MgO和CO2,再加水消化,其中MgO、CaO均水反应生成Mg(OH)2和Ca(OH)2,经过滤除去SiO2、Fe2O3等残渣,再向所得溶液中通入CO2气体进行碳化,使得Mg(OH)2转化为可溶的Mg(HCO3)2,经过滤除去CaCO3,将所得Mg(HCO3)2溶液加热并控制温度95~100℃即得到碱式碳酸镁,最后过滤并洗涤得到产品。
![]() 白云石“煅烧”时发生主要反应的化学方程式为
白云石“煅烧”时发生主要反应的化学方程式为 ![]()
![]()
![]() ;
;
![]() 由图像知当
由图像知当![]() 时碱式碳酸镁的产率最高,氧化钙的含量最小,则应控制“碳化”终点pH 约为
时碱式碳酸镁的产率最高,氧化钙的含量最小,则应控制“碳化”终点pH 约为![]() ;
;
![]() 图
图![]() 中,当
中,当![]()
![]() 时,镁元素的主要存在形式是;
时,镁元素的主要存在形式是;
![]() “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
![]() 根据题意知
根据题意知![]() ,
,![]() ,根据电荷守恒知
,根据电荷守恒知![]() ,由图像知水占总质量的
,由图像知水占总质量的![]() ,则
,则![]() ,则碱式碳酸镁晶体的化学式为
,则碱式碳酸镁晶体的化学式为![]() 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】“大同”化学小组在实验室中对![]() 进行探究。回答下列问题:
进行探究。回答下列问题:
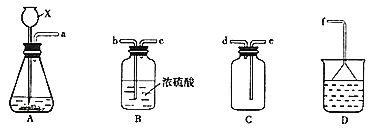
(1)![]() 学生甲用下图E装置制备
学生甲用下图E装置制备![]() 。主反应的发生,表明硫酸具有的性质有________
。主反应的发生,表明硫酸具有的性质有________

A.氧化性 ![]() 还原性
还原性 ![]() 酸性
酸性 ![]() 碱性
碱性
![]() 学生乙以
学生乙以![]() 粉未和
粉未和![]() 为原料制取
为原料制取![]() ,反应的化学方程式是:___
,反应的化学方程式是:___
![]() 现欲收集一瓶干燥的
现欲收集一瓶干燥的![]() ,选用下图中的A、B、C、D装置,其连接顺序
,选用下图中的A、B、C、D装置,其连接顺序![]() 按气流方向,用小写字母表示,可重复选用
按气流方向,用小写字母表示,可重复选用![]() 为:_________
为:_________
(2)学生丙用浓![]() 和蔗糖反应,得到的气体中含有
和蔗糖反应,得到的气体中含有![]() 、
、![]() 。现选择下图中的装置,验证混合气体中存在
。现选择下图中的装置,验证混合气体中存在![]() 和
和![]() 。其中,能证明存在
。其中,能证明存在![]() 的现象是_____。
的现象是_____。
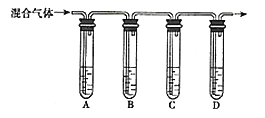
(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
![]() 黑色固体可能含有CuO、CuS、
黑色固体可能含有CuO、CuS、![]() 。
。
![]() 和
和![]() 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
![]() 向含微量
向含微量 ![]() 的溶液中滴加
的溶液中滴加![]() 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。
现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加![]() 溶液,未见红褐色沉淀,由此所得结论是_____________________。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:__________为测定黑色沉淀中
溶液,未见红褐色沉淀,由此所得结论是_____________________。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:__________为测定黑色沉淀中![]() 的百分含量,取
的百分含量,取![]() 黑色沉淀,在酸性溶液中用
黑色沉淀,在酸性溶液中用 ![]() 溶液处理,发生反应如下:
溶液处理,发生反应如下:![]()
![]() ,反应后煮沸溶液,赶尽
,反应后煮沸溶液,赶尽![]() ,过量的高锰酸钾溶液恰好与
,过量的高锰酸钾溶液恰好与![]() 溶液完全反应。则混合物中
溶液完全反应。则混合物中![]() 的质量分数为 ___________
的质量分数为 ___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
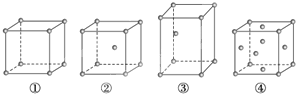
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA
B.完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA
C.100g 98%的浓硫酸中含氧原子个数为4NA
D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述不正确的是( )
A.氯化钠和氯化铯晶体中,阴离子的配位数均为6
B.金刚石为空间网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰主要成分是碳酸钾。现从草木灰中提取钾盐,并用实验检验其中的S![]() 、C
、C![]() 和Cl-。
和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解和沉淀,③______,④_______,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示___。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行②③④操作时都要用到玻璃棒,其作用分别是_____、______、______。
(4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在三支试管里。
①在第一支试管里加入稀盐酸,可观察有___生成,证明溶液中有_____;
②在第二支试管里加入足量稀盐酸后,再加入氯化钡溶液,可观察有________生成,证明溶液中有__________;
③在第三支试管里加入足量稀硝酸后,再加入硝酸银溶液,可观察有______生成,证明溶液中有Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞的结构简式如图,下列关于酚酞的说法一定正确的是
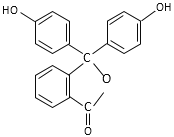
A. 酚酞的分子式是C20H12O4
B. 分子中的碳原子不在同一平面
C. 1 mol酚酞最多可消耗2 mol NaOH
D. 常温下,由水电离的c(H+)=10-13mol·L-1的溶液中滴入酚酞试液后,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
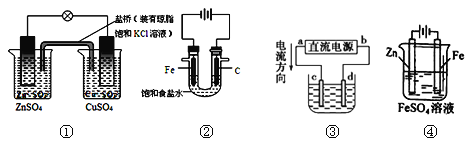
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05gcm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
I.制备粗产品:如图所示装置中,于50ml圆底烧瓶中加入8.0g苯甲酸(Mr=122)、20ml乙醇(Mr=46,密度0.79gcm-3)、15ml环己烷、3ml浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
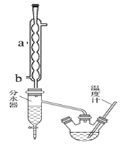
粗产品纯化:加水30ml,分批加入固体NaHCO3,分液,然后水层用20ml石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213℃馏分。
相关数据如下:
沸点(℃,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物 |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式_____________________________________,
仪器a的名称______________,冷凝水的进水口为______(填a或b)。
(2)在本实验中可以提高苯甲酸乙酯产率的方法有:_________________________________。
A.加入环已烷形成水![]() 乙醇
乙醇![]() 环已烷三元共沸物分离出反应过程中生成的水
环已烷三元共沸物分离出反应过程中生成的水
B.加过量的乙醇
C.使用分水器及时分离出生成的水
(3)如何利用实验现象判断反应已基本完成_____________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3后实验操作分液所用到的主要玻璃仪器为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com