
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA
B.完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA
C.100g 98%的浓硫酸中含氧原子个数为4NA
D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
【答案】B
【解析】
A、N2和H2生成NH3是可逆反应,1molN2和3molH2充分反应生成NH3小于2mol所以生成物中的N—H键数目小于6NA,A项错误;
B、CH3CH20H+3O2=2CO2+3H2O,C2H4+3O2=2CO2+2H2O,1.5mol气体反应转移电子都是1.8mol即18NA,所以完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA,B项错误;
C、l00g、98%的浓硫酸中m(H2SO4)= l00g×98%=98g,n=![]() =1mol,其中N(O)=4NA,但是溶液中还有水,加上水中的O就大于4NA,C项错误;
=1mol,其中N(O)=4NA,但是溶液中还有水,加上水中的O就大于4NA,C项错误;
D、因为Na2S溶液中S2-会发生水解生成HS一和H2S,根据S原子守恒得n(S2-)+n(HS-)+n(H2S)= 1L×0.1 mol/L=1mol,所以S2-、HS-和H2S的总数为0.1NA,D项错误;
故答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1∶1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
A.①③⑥⑧B.③⑦⑧
C.②⑤⑥⑦D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式见图,下列说法正确的是( )
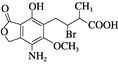
A. 分子式为C14H16O6NBr
B. 该分子中含有两个手性碳原子
C. 不能使酸性高锰酸钾溶液褪色
D. 在一定条件下与氢氧化钠溶液反应,1 mol该有机物最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: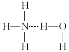
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
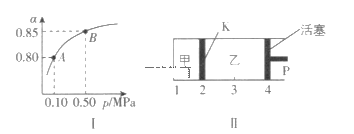
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁![]() 是重要的无机化工产品。一种由白云石
是重要的无机化工产品。一种由白云石![]() 主要成分为
主要成分为![]() ,还含少量
,还含少量![]() 、
、![]() 等
等![]() 为原料制备碱式碳酸镁
为原料制备碱式碳酸镁![]() 国家标准中CaO的质量分数
国家标准中CaO的质量分数![]()
![]() 的实验流程如下:
的实验流程如下:

![]() “煅烧”时发生主要反应的化学方程式为________________。
“煅烧”时发生主要反应的化学方程式为________________。
![]() 常温常压下“碳化”可使镁元素转化为
常温常压下“碳化”可使镁元素转化为![]() ,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
图1 CaO含量与碳化终点pH的关系
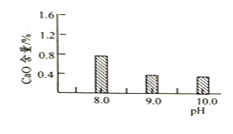
图2碱式碳酸镁产率与碳化终点pH的关系
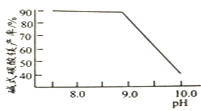
![]() 应控制“碳化”终点PH约为__________。
应控制“碳化”终点PH约为__________。
![]() 图
图![]() 中,当
中,当![]()
![]() 时,镁元素的主要存在形式是__________________
时,镁元素的主要存在形式是__________________![]() 写化学式
写化学式![]() 。
。
![]() “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________。
![]() 一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
一种测定碱式碳酸镁img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />组成的方法如下:
![]() 称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体![]() 标准状况
标准状况![]() ;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体![]() 。
。
![]() 另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率![]() 固体样品的剩余质量
固体样品的剩余质量![]() 固体样品的起始质量
固体样品的起始质量![]() 随温度的变化如下图所示
随温度的变化如下图所示![]() 样品在
样品在![]() 时完全失去结晶水
时完全失去结晶水![]() 。
。
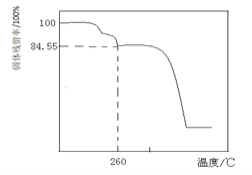
根据以上实验数据计算确定碱式碳酸镁晶体的化学式![]() 写出计算过程
写出计算过程![]() _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
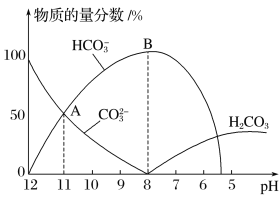
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A. 电子由电极A经外电路流向电极B
B. 该电池工作时,每消耗22.4L NH3转移3mol电子
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com