
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:

已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中![]() 等于_________________
等于_________________
【答案】 六 ![]() H2SiO3 C WO42-+2H+=H2WO4↓ 取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀 如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题。 5×10-5
H2SiO3 C WO42-+2H+=H2WO4↓ 取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀 如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题。 5×10-5
【解析】白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,白钨矿与碳酸钠在1000℃温度下反应,二氧化硅与碳酸钠会反应生成硅酸钠,氧化铁不反应,得到的混合物用水浸取,过滤后的滤液经过系列操作得到WO3,说明碳酸钠与CaWO4反应生成Na2WO4,则滤渣A为氧化铁等,滤液中含有Na2SiO3、Na2WO4,再调节pH在5~8之间,使硅酸根转化为H2SiO3沉淀过滤除去,母液中含有Na2WO4,再加入盐酸得到沉淀C为H2WO4,灼烧产生三氧化钨和水,再还原得到钨;
(1)由74-2-8-8-18-32=6,可钨处于第六周期;
(2)CaWO4与纯碱反应生成Na2WO4、CaO与二氧化碳,反应方程式为:CaWO4+Na2CO3![]() Na2WO4+CaO+CO2↑;
Na2WO4+CaO+CO2↑;
(3)滤渣B的主要成分为H2SiO3,调节溶液pH使硅酸根转化为H2SiO3沉淀过滤除去,应加入盐酸;
(4)母液中Na2WO4与盐酸得到H2WO4沉淀与氯化钠,反应离子方程式为:WO42-+2H+=H2WO4↓;检验沉淀C是否洗涤干净的操作是:取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净;
(5)如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题;
(6)当溶液中WO42-恰好沉淀完全,其离子浓度等于10-5mol/L,根据Ksp(CaWO4)=c(Ca2+)×c(WO4-)=1×10-10,则溶液中c(Ca2+)=1×10-5mol/L,再根据Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=4×10-7,可知c(OH-)=0.2mol/L,则溶液中![]() =5×10-5。
=5×10-5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
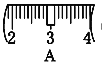
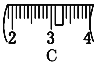
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,2.24 L H2O所含的原子数为0.5NA
B. 1 mL 1 mol/L NaCl溶液中离子总数为2NA
C. 18 g的H2O中含有的电子数为3NA
D. 标准状况下,22.4 L氩气所含质子数为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。很多鲜花和水果的香味都来自酯的混合物。现在可以通过人工方法合成各种酯,用作饮料、糖果、香水、化妆品中的香料,也可以用作指甲油、胶水的溶剂。下图是工业上以A为主要原料来合成乙酸乙酯的合成路线。其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工发展水平。又知2CH3CHO+O2![]() 2CH3COOH。请回答下列问题
2CH3COOH。请回答下列问题
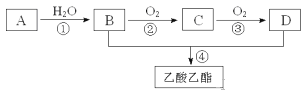
(1)B、D分子内含有的官能团分别是_________、_________(填名称)。
(2)写出下列反应的反应类型:①______________,④______________。
(3)写出下列反应的化学方程式:
②_______________________________________________________;
④____________________________________________________。
(3)A与H2在催化剂作用下充分反应生成E,E的同系物F比E多三个碳原子,请写出F的所有同分异构体的结构简式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,易挥发,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸晶体(H2C2O4 · 2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_____,由此可知草酸晶体分解的产物中有_____,装置B的主要作用是_____。

(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可重复选用)进行实验。


①乙组同学的实验装置中,依次连接的合理顺序为A、B、_____,装置H中装有的物质是_____。
②能证明草酸晶体分解产物中有CO的现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)常温下Y的单质能与水发生反应,则X位于周期表_________,X、Y形成简单离子半径大小关系为X_____________Y(填“大于”、“小于”或“等于”)。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
①则甲为___________(填化学式)。该气体能使高锰酸钾溶液褪色,该反应的离子方程式为_______________。
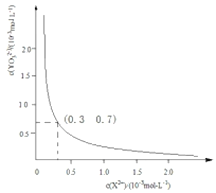
②25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液X2+离子沉淀完全,则加入![]() 离子的最小浓度为___________molL﹣1。
离子的最小浓度为___________molL﹣1。
(3)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙中所含化学键类型____________。
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com