
【题目】下列有关物质性质和用途正确的是
A. 工业上可以利用石灰水与氯气反应制备漂白粉
B. 明矾可用于自来水的杀菌消毒
C. Na-K合金可作为原子反应堆的导热剂
D. Na2CO3能与盐酸反应,广泛用于治疗胃酸过多
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100 g CaCO3晶体和136 g KHSO4晶体中含有的离子数分别为2 NA 和3 NA
C. 3mol Fe在纯氧中完全燃烧转移的电子数为8NA
D. 已知:N2(g)+3H2(g) ![]() 2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1) __________
__________
(2) ____________
____________
(3)![]() ___________
___________
(4)![]() ____________
____________
(5)2,6-二甲基-4-乙基辛烷_______
(6)2-甲基-1-戊烯____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )

A. a点溶液的pH=2
B. c点溶液中:c(Yˉ)>c(Na+)>c(HY)>c(H+)>c(OHˉ)
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. 水的电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= —24.8 kJ·mol-1;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ·mol-1 ;Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +19.4kJ·mol-1则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为
A. 放出11 kJ B. 放出5.5kJ C. 吸收11 kJ D. 吸收5.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图为其工作原理和废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
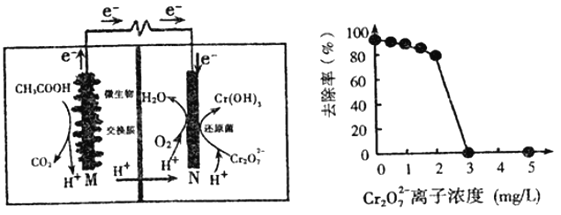
A. 反应一段时间后,N极附近的溶液pH下降
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. M为电池正极,CH3COOH被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是

A. 电解质溶液中Na+向b极移动
B. b极的电极反应是:O2+2H2O+4e-=4OH-
C. a极是负极,发生氧化反应
D. 电子通过外电路从b电极流向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)=CO(g)+2H2(g),此反应能自发进行的原因是______________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):

(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上正极板的质量增加___g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成___、B电极上生成____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com