
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A. 还原性 B. 氧化性 C. 酸性 D. 碱性
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]()
![]()
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
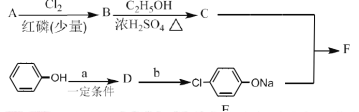
(1)A为一元羧酸,8.8gA与足量![]() 溶液反应生成2.24L
溶液反应生成2.24L![]() (标准状况),A的分子式为__________。
(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出![]() 的反应方程式:__________。
的反应方程式:__________。
(4)![]() 的反应类型为__________。
的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为![]() ,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。

(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 用浓盐酸分别和KMnO4、KClO3反应制备l mol氯气,转移的电子数均为2NA
D. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的离子方程式(标明化学方程式的除外)
(1)Na2S溶液和AgNO3溶液混合:_____________。
(2)硫磺与足量浓NaOH溶液共热,其中一种产物为Na2SO3: _____________。
(3)灭火器中NaHCO3与Al2(SO4)3溶液混合: _____________。
(4)工业流程中除去溶液中Fe3+时,也可采用以下方法:将pH值调整到1.6~1.8左右,并将溶液加热至85~95℃时,加入适量Na2SO4,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,反应的离子方程式为______________。
(5)含0.300molH3PO4的水溶液滴加到含0.500molCa(OH)2的悬浊液中,反应恰好完全,生成1种难溶盐和16.2gH2O。反应的化学方程式为______________。
(6)向一定比例的CuSO4、NaCl溶液中加入一定量的Na2SO3溶液可制得CuCl白色沉淀,并有刺激性气味气体产生: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 ( )
A. 30% B. [(26.5+3.5)/(100+6.5)]×100%
C. 26.5% D. [(26.5+3.5)/(100+6.5+3.5)]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
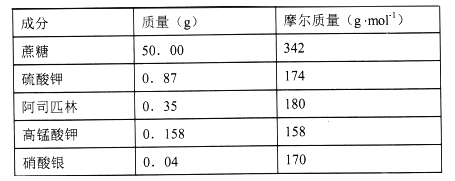
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是_________。
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银 E.水
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__mol/L。
(3)配制上述500mL“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、量筒、胶头滴管、_____。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作会使配制结果浓度偏低的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液时未洗涤烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E.加水时超过刻度线,用胶头滴管吸出
F.未冷却至室温就注入容量瓶定容
(5)“花卉保鲜剂”中高锰酸钾的主要作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com