
【题目】某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 ( )
A. 30% B. [(26.5+3.5)/(100+6.5)]×100%
C. 26.5% D. [(26.5+3.5)/(100+6.5+3.5)]×100%
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. K2FeO4可代替Cl2处理饮用水,有杀菌消毒作用
B. CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为1:2
C. 《本草纲目》中“以火烧之,紫青烟起,乃真硝石”利用焰色反应区分硝石(KNO3)和朴硝(Na2SO4)
D. 高温下可用金属钠还原四氯化钛来制取金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A. 还原性 B. 氧化性 C. 酸性 D. 碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是ClO-和Cl-,在75℃以上、浓碱溶液中主要产物是ClO3-和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。

a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的离子方程式为_______________。
②若取消装置II,对本实验的影响是_______________。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是_______________。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______________。
(2)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去C1O-的离子方程式是_____________。“煮沸”的目的是_________。
②比较碱性条件下氧化性ClO3-_______C1O-(填写“>”或“<”)。
③样品中KClO3的貭量分数为________。(答案保留三位有效数字,KClO3式量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香草醛(3-乙氧基-4-羟基苯甲醛)是一种广泛使用的可食用香料。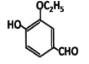 与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
A. 6种 B. 15种 C. 18种 D. 21种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(______)
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中4 mol的氧化剂能________(填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com