
【题目】下列变化过程只有通过氧化反应才能实现的是( )
A.HCl→H2B.HCl→FeCl2C.H2SO4(浓)→SO2D.Fe→Fe2O3
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
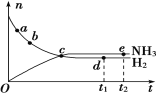
A. 点a的正反应速率比点b的小B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的离子方程式(标明化学方程式的除外)
(1)Na2S溶液和AgNO3溶液混合:_____________。
(2)硫磺与足量浓NaOH溶液共热,其中一种产物为Na2SO3: _____________。
(3)灭火器中NaHCO3与Al2(SO4)3溶液混合: _____________。
(4)工业流程中除去溶液中Fe3+时,也可采用以下方法:将pH值调整到1.6~1.8左右,并将溶液加热至85~95℃时,加入适量Na2SO4,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,反应的离子方程式为______________。
(5)含0.300molH3PO4的水溶液滴加到含0.500molCa(OH)2的悬浊液中,反应恰好完全,生成1种难溶盐和16.2gH2O。反应的化学方程式为______________。
(6)向一定比例的CuSO4、NaCl溶液中加入一定量的Na2SO3溶液可制得CuCl白色沉淀,并有刺激性气味气体产生: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 ( )
A. 30% B. [(26.5+3.5)/(100+6.5)]×100%
C. 26.5% D. [(26.5+3.5)/(100+6.5+3.5)]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
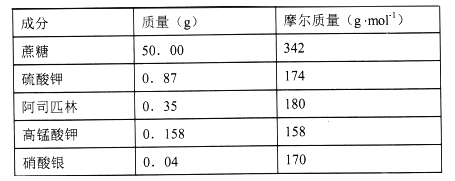
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是_________。
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银 E.水
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__mol/L。
(3)配制上述500mL“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、量筒、胶头滴管、_____。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作会使配制结果浓度偏低的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液时未洗涤烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E.加水时超过刻度线,用胶头滴管吸出
F.未冷却至室温就注入容量瓶定容
(5)“花卉保鲜剂”中高锰酸钾的主要作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)实验步骤①的目的是___________________________________________。
(2)写出实验步骤②中的化学方程式__________________________________________。
(3)补全实验步骤③的操作名称_________________________。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是_______________________________。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你______(填“是”或“否”)同意乙的观点
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
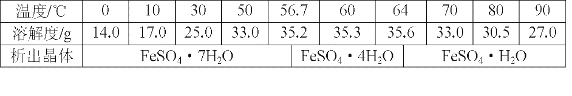
请根据表中数据画出硫酸亚铁的溶解度曲线示意图。__
(7)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________________。
(8)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100 mL用c mol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com