
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(______)
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中4 mol的氧化剂能________(填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
【答案】AD Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 6NH4Cl+4Fe2O3===6Fe+2FeCl3+3N2↑+12H2O NH4Cl 得到 18 80 g NaCl 氧化 生成Fe(OH) 3在水中形成胶体能够吸附水中悬浮杂质 AB
Fe(OH)3(胶体)+3H+ 6NH4Cl+4Fe2O3===6Fe+2FeCl3+3N2↑+12H2O NH4Cl 得到 18 80 g NaCl 氧化 生成Fe(OH) 3在水中形成胶体能够吸附水中悬浮杂质 AB
【解析】
本题主要考查氧化还原反应知识的综合应用。依据“元素化合价升高、失去电子、发生氧化反应;元素化合价降低、得到电子、发生还原反应,失电子的反应物是还原剂,得电子的反应物是氧化剂”等知识分析。
(1)A.铁在冷的浓硝酸中钝化,A项正确;B.生铁中含碳,在潮湿的空气中生铁形成原电池,发生电化腐蚀,易生锈,B项错误;C.不锈钢是铁合金,还含碳等非金属元素,C项错误;D.红热的铁与高温水蒸气反应:3Fe+4H2O(g)![]() Fe3O4+4H2(g),D项正确;答案选AD。
Fe3O4+4H2(g),D项正确;答案选AD。
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,得到透明的红褐色的Fe(OH)3胶体,其反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(3)①铁锈的主要成分是Fe2O3,该反应的反应物是NH4Cl和Fe2O3,生成物有FeCl3和N2,分析化合价知,氮元素由-3价升高到N2中的0价,每个氮原子升高3价,铁元素化合价由+3价降到Fe的0价,每个铁原子降低3价,根据化合价升降守恒配平NH4Cl、Fe2O3、Fe、N2的计量数,再根据氧原子和氢原子守恒推知X是H2O,并确定FeCl3和H2O计量数,配平了的反应方程式为:6NH4Cl+4Fe2O3===6Fe+2FeCl3+3N2↑+12H2O
②NH4Cl的氮元素化合价由-3价升高到N2的0价,所以NH4Cl发生氧化反应。Fe2O3是氧化剂,4molFe2O3中有6mol铁元素的化合价由+3从降低到Fe的0价,得到18mol电子,所以反应中4mol氧化剂能得到18mol电子;
③根据反应方程式知,每生成3molN2就要消耗4molFe2O3,但4molFe2O3中只有3molFe2O3(被还原的铁原子是6mol)被还原,因此有关系式:3Fe2O3(被还原)~3N2↑。11.2 L(标准状况)的N2的物质的量为0.5mol,所以,反应中产生了11.2 L(标准状况)的气体时,被还原的物质的量为0.5mol,其质量为0.5mol×160g/mol=80g ;
(4)①根据化学方程式中原子守恒可确定X是NaCl;
②高铁酸钠在水中的反应方程式可知,FeO42-具有很强的氧化性,杀菌消毒原理与HClO相似,都是具有强氧化性的原因。高铁酸钠在水中被还原为Fe3+,而Fe3+发生水解反应生成的Fe(OH)3胶体具有吸附作用,能够吸附水中悬浮的杂质。
③A.KAl(SO4)212H2O溶于水时电离出来的Al3+能发生水解反应,水解生成的Al(OH)3胶体能吸附水中的悬浮物,A项正确;B. 聚合硫酸铁[Fe(OH)(SO4)]n具有吸附作用,能够除去水中的悬浮物,B项正确;C.ClO2有强氧化性,具有杀菌消毒作用,但不能吸附水中的悬浮物,不能作净水剂,C项错误;D.“84”消毒液主要成分是NaClO,具有强氧化性,能杀菌消毒,不能作净水剂,D项错误;答案选AB。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。

(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 ( )
A. 30% B. [(26.5+3.5)/(100+6.5)]×100%
C. 26.5% D. [(26.5+3.5)/(100+6.5+3.5)]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
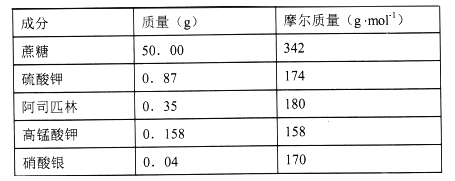
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是_________。
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银 E.水
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__mol/L。
(3)配制上述500mL“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、量筒、胶头滴管、_____。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作会使配制结果浓度偏低的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液时未洗涤烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E.加水时超过刻度线,用胶头滴管吸出
F.未冷却至室温就注入容量瓶定容
(5)“花卉保鲜剂”中高锰酸钾的主要作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
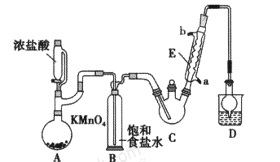
【题目】某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产三氯乙醛(CCl3CHO)的方法,由乙醇与氯气作用,制得三氯乙醛。
查阅资料,有关信息如下:
①制备反应原理:![]()
可能发生的副反应:![]()
![]()
②相关物质的相对分子质量及部分物理性质:
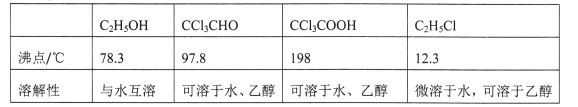
(1)仪器C和E的名称分别是____,____。
(2)仪器A中发生反应的离子方程式为____ 。
(3)该装置C最好采用____加热的方法,以控制反应温度在70℃左右。
(4)该设计流程中存在一处缺陷,该缺陷可能引起的后果是________。
(5)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_____(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒具有相同的质子数和电子数的是( )。
A. OH-、H2O、F- B. NH3、NH4+、NH2-
C. H3O+、NH4+、NH2- D. HCl、F2、H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com