
【题目】下列各组微粒具有相同的质子数和电子数的是( )。
A. OH-、H2O、F- B. NH3、NH4+、NH2-
C. H3O+、NH4+、NH2- D. HCl、F2、H2S
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(______)
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中4 mol的氧化剂能________(填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采取CO(g)和H2(g)合成CH3OH(g)
(1)已知某温度和压强下
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
则在相同温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式__________。若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
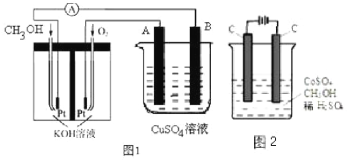
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
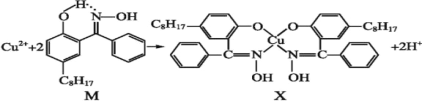
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
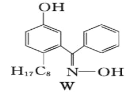
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。
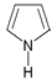
(8)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_________________。
(2)固体混合物中氧化铜的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是( )
A. 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯
B. ![]() 是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 淀粉与纤维素互为同分异构体,二者水解的最终产物相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com