
【题目】氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
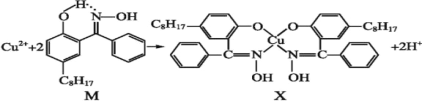
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
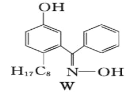
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。
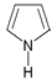
(8)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
【答案】 配位键或δ键 CDEF CO2或N2O 两者都是分子晶体,肼分子间氢键数目比氨分子多,分子间作用力大,沸点更高 N、O或N、O2- sp2 W ![]()
【解析】
(1)N2H62+是由N2H4结合质子形成的,因此N2H62+中共价键的类型除极性键,非极性键外还有配位键或δ键。
(2)NH2-与H2O互为等电子体,二者的结构与性质相似,则根据水分子的结构与性质可判断H-N-H夹角大约105°,中心原子的杂化轨道为四面体形,其空间构型为V形,易与H+结合,答案选CDEF;
(3)原子数和价电子数分别都相等的互为等电子体,则与N3-的等电子体且是中性分子的物质为CO2或N2O;
(4)由于两者都是分子晶体,肼分子间氢键数目比氨分子多,分子间作用力大,沸点更高,所以其沸点比氨气高;
(5)由于氧原子和氮原子均含有孤对电子,则X中配位原子是N和O;
(6)由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化;
(7)由于M能形成分子内氢键,使溶解度减小,而W能形成分子间氢键,则在水中溶解度较大的物质是W;
(8)根据结构简式可知吡咯环中的大π键是由5个原子提供6个电子形成的,则形成的π键可表示为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成X2Y和X2Y2两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物X2Y电子数的两倍,则以下说法错误的是( )
A. 氢化物的稳定性为Y>Z B. X2Y2的电子式为![]()
C. WY2 中既含有共价键又含有离子键 D. WX2能与X2Y反应生成X2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒具有相同的质子数和电子数的是( )。
A. OH-、H2O、F- B. NH3、NH4+、NH2-
C. H3O+、NH4+、NH2- D. HCl、F2、H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铝、镁、钛,均是人类大量生产和使用的金属。试回答下列问题:
(1)一个原子有多级电离能,从电子排布特点判断第三电离能大小:Mg______Al(填大于或等于或小于)。
(2)钛被称为继铁、铝之后的第三金属。第四周期元素中,未成对电子数目与基态钛原子未成对电子数目相同元素还有__________种。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中的位置_______。
(4)Ag+与氨水形成的二氨合银离子空间构型是直线形,其中配位原子的杂化类型是______。
(5)四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,能与水蒸气反应发烟,生成二氧化钛固体,可以做烟幕剂。四氯化钛中存在的化学键类型是_______,写出上述反应的化学方程式____________________。
(6)工业用电解氯化镁制得镁,而不用氧化镁的原因___________________________。
(7)金单质的晶胞是面心立方结构,已知金相对原子质量为M,晶胞边长为d cm,则一个该晶胞占有的原子总质量为________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加热才能发生的反应一定是吸热反应
B.化学反应的热效应的大小与参加反应的物质的多少无关
C.反应物的总能量大于生成物的总能量的反应一定是放热反应
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应的认识正确的是( )
A.化学反应过程中,断键吸热,成键放热
B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
C.对于同一个化学反应,一步完成和分几步完成,其反应的焓变不相同
D.反应物的总焓大于反应产物的总焓时,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:

(1)实验开始前,鼓入氮气排出空气的目的是_____________________________。
(2)检验水和二氧化碳的装置分别是_______和_______。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4_______________________________________________________________(简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。
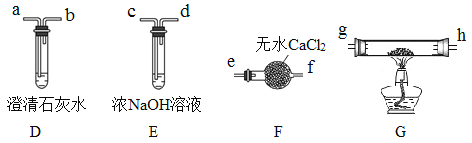
(4)乙组同学的实验装置中,依次连接的合理顺序为x→______g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是___________。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com