
����Ŀ��������֮���ת����ϵ��ͼ������������ʡ�ԣ�C��D����X��Y��Z������Ԫ����ɵĻ����X��Y��Z��ԭ�������������������ڱ���X��ԭ�Ӱ뾶��С��Y��Zԭ������������֮��Ϊ10��DΪ��ɫ�ǿ�ȼ�����壬GΪ����ɫ�������壬J��MΪ������I��Ư�����ã���Ӧ�ٳ���������ӡˢ��·�壮��ش��������⣺
��1��GԪ�������ڱ��е�λ�� �� C�ĵ���ʽ ��
��2���Ƚ�Y��Z��ԭ�Ӱ뾶��С������дԪ�ط��ţ���
��3��д��E����ȩ��Ӧ�Ļ�ѧ��Ӧ����ʽ���л����ýṹ��ʽ��ʾ������Ӧ���ͣ� ��
��4��д��ʵ�����Ʊ�G�����ӷ�Ӧ����ʽ ��
��5������D��NaOH��Һ��Ӧ������������P��Q����P��Na����������Ϊ43%��������Ϊ ��
��6��ʵ�����м���L��Һ�е������ӳ�ѡ����Һ�������� ��
��7��A�а���X��Y��ZԪ�أ�A�Ļ�ѧʽΪ
��8���о�����������D��һ�������¿ɱ���ԭΪ��Ө���ľ���N����ṹ��ԭ�ӵ�����Ϊ�������壬��д��N����1��ͬ��������������� ��
���𰸡�
��1���������ڵڢ���A�壻![]()
��2��C��O
��3��CH3CHO+2Cu��OH��2 ![]() CH3COOH+Cu2O��+2H2O��������Ӧ
CH3COOH+Cu2O��+2H2O��������Ӧ
��4��MnO2+4H++2Cl�� ![]() ?Mn2++Cl2��+2H2O
?Mn2++Cl2��+2H2O
��5���մ�
��6��KSCN��Һ����Һ����Ѫ��ɫ
��7��Cu2��OH��2CO3��Cu��OH��2?CuCO3
��8�����ʯ����ʯī����ϩ��C60��
���������⣺X�����ڱ��е�ԭ�Ӱ뾶��С��ΪHԪ�أ�Y��Zԭ������������֮��Ϊ10����X��Y��Z��ԭ�������������������Ƴ�D����H��C��O�е�����Ԫ����ɣ���ɫ�ǿ�ȼ�����壩ΪCO2 �� ����֪��X��Y��Z��H��C��O����CΪH2O��HΪHCl��I��Ư�����ã�ӦΪHClO��dz��ɫ���ػ�ɫ��ҺΪFe2+��Fe3+ �� ��֪JΪFe��KΪFeCl2 �� LΪFeCl3 �� GΪ����ɫ�������壬ӦΪCl2 �� ��Ӧ����������ӡˢ��·��ΪFeCl3��Cu����MΪCu��BΪCuCl2 �� E���������Ƿ�Ӧ��ӦΪCu��OH��2 �� FΪCu2O����A+H��HCl��=B��CuCl2��+C��H2O��+D��CO2����֪��A�Ǻ���Cu2+��̼���Σ���A+H��HCl��=B��CuCl2��+C��H2O��+D��CO2����֪��A�Ǻ���Cu2+��̼���Σ�ӦΪCuCO3��Cu2��OH��2CO3��Cu��OH��2CuCO3 �� A�а���X��Y��ZԪ�أ�A�Ļ�ѧʽΪCu2��OH��2CO3��Cu��OH��2CuCO3 �� ��1��GΪCl2 �� GԪ�������ڱ��е�λ���ǵ������ڵڢ���A�壬CΪH2O��C�ĵ���ʽΪ ![]() �����Դ��ǣ��������ڵڢ���A�壻
�����Դ��ǣ��������ڵڢ���A�壻 ![]() ����2��Y��Z�ֱ���C��O������ͭ����ԭ�Ӱ뾶���μ�С�жϣ�C��O��ԭ�Ӱ뾶C��O�����Դ��ǣ�C O����3��EΪCu��OH��2 �� E����ȩ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ CH3CHO+2Cu��OH��2
����2��Y��Z�ֱ���C��O������ͭ����ԭ�Ӱ뾶���μ�С�жϣ�C��O��ԭ�Ӱ뾶C��O�����Դ��ǣ�C O����3��EΪCu��OH��2 �� E����ȩ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ CH3CHO+2Cu��OH��2 ![]() CH3COOH+Cu2O��+2H2O����Ӧ����Ϊ������Ӧ�����Դ��ǣ�CH3CHO+2Cu��OH��2
CH3COOH+Cu2O��+2H2O����Ӧ����Ϊ������Ӧ�����Դ��ǣ�CH3CHO+2Cu��OH��2 ![]() CH3COOH+Cu2O��+2H2O��������Ӧ�� ��4��ʵ������Ũ������������̷�Ӧ�Ʊ���������Ӧ�����ӷ�Ӧ����ʽΪMnO2+4H++2Cl��
CH3COOH+Cu2O��+2H2O��������Ӧ�� ��4��ʵ������Ũ������������̷�Ӧ�Ʊ���������Ӧ�����ӷ�Ӧ����ʽΪMnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl��
Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O�� ��5��DΪCO2 �� CO2��NaOH��Һ��Ӧ������������ΪNaHCO3��Na2CO3 �� ��Na2CO3��Na����������Ϊ43%��������Ϊ�մ����Դ��ǣ��մ� ��6��LΪFeCl3 �� ʵ�����м���L��Һ�е������ӳ�ѡ��KSCN��Һ����������Һ����Ѫ��ɫ�����Դ��ǣ�KSCN��Һ����Һ����Ѫ��ɫ�� ��7����������ķ�����֪��A�Ļ�ѧʽΪCu2��OH��2CO3��Cu��OH��2CuCO3 �� ���Դ��ǣ�Cu2��OH��2CO3��Cu��OH��2CuCO3�� ��8��CO2���Ի�ԭ����������ṹ�ľ���N�������ϼ۽��ͣ���Ȼ�����˽��ʯ������ͬ�����������Ϊ��̼�ĵ��ʣ�ͬ�������������Ϊ��ʯī������ϩ��C60���� ���Դ��ǣ����ʯ��ʯī����ϩ��C60����
Mn2++Cl2��+2H2O�� ��5��DΪCO2 �� CO2��NaOH��Һ��Ӧ������������ΪNaHCO3��Na2CO3 �� ��Na2CO3��Na����������Ϊ43%��������Ϊ�մ����Դ��ǣ��մ� ��6��LΪFeCl3 �� ʵ�����м���L��Һ�е������ӳ�ѡ��KSCN��Һ����������Һ����Ѫ��ɫ�����Դ��ǣ�KSCN��Һ����Һ����Ѫ��ɫ�� ��7����������ķ�����֪��A�Ļ�ѧʽΪCu2��OH��2CO3��Cu��OH��2CuCO3 �� ���Դ��ǣ�Cu2��OH��2CO3��Cu��OH��2CuCO3�� ��8��CO2���Ի�ԭ����������ṹ�ľ���N�������ϼ۽��ͣ���Ȼ�����˽��ʯ������ͬ�����������Ϊ��̼�ĵ��ʣ�ͬ�������������Ϊ��ʯī������ϩ��C60���� ���Դ��ǣ����ʯ��ʯī����ϩ��C60����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��C��H��O����Ԫ�ص�δ֪��X,��ʵ��ⶨ��������Ԫ�ص���������Ϊ̼72.0%����6.67%�������X����Է�������Ϊ150�����й���X��˵����ȷ����
A. ʵ��ʽ�ͷ���ʽ��ΪC9H10O
B. �����ܺ��б���
C. 1 mol X��ȫȼ�գ�������5 molˮ
D. ��δ���X����Է���������Ҳ��ȷ��X�ķ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ��
��1����ӦA+3B2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ����£�
�٣�v��B ��=3.6molL��1min��1 �ڣ�v��A ��=0.15molL��1s��1
�ۣ�v��C��=0.5molL��1s��1 �ܣ�v��D��=0.6molL��1s��1 ��
�÷�Ӧ���е��ɿ쵽��˳��Ϊ ������ţ�
��2����֪��1mol H��H����1mol N��H����1mol N��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ��±���Ԫ�����ڱ���һ���֣�����������ĸA��B��D��E��G��H��Q��M��R�ֱ����ijһ��ѧԪ�أ���������Ԫ�ػش��������⣮������Ԫ�ط�����д��
��1����ѡ�����ԭ���������ĺ���������д���ط��ţ���BԪ����Ԫ�����ڱ��е�λ�� ��
��2��E��Q��R����Ԫ��ԭ���γɵļ����Ӿ�����ͬ���Ӳ�ṹ�����а뾶�������ӵ����������ӷ��ţ��� д��MD2���ӵĽṹʽ�� ��
��3��ѡȡ����Ԫ�أ��γɼȺ������Ӽ��ֺ��й��ۼ��Ļ�����û��������ʽΪ������������ˮ�����У�������ǿ�Ļ��������ʽΪ ��
��4���ñ�������Ԫ����ɷ�Ӧ������һ����ѧ����ʽ˵����Ԫ��Q��R�ǽ����Ե�ǿ������
Ԫ��G��H�Ľ�����ǿ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������δ�����������Դ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼�����2H2O ![]() 2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ��Իش��������⣺
2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ��Իش��������⣺
��1���ֽ⺣ˮʱ��ʵ���˴ӹ���ת��Ϊ�ܣ����ɵ���������ȼ�ϵ��ʱ��ʵ���˻�ѧ��ת��Ϊ�ܣ��ֽ⺣ˮ�ķ�Ӧ������Ӧ������ȡ������ȡ�����
��2��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A��B�����Ϸ����ĵ缫��Ӧ�ֱ�Ϊ A����2H2+2O2����4e���T2H2O����A���ǵ�ص��������ӴӸü�������롱������������B���缫��Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�ӵĵ�n���Ӳ��У����������������Ӳ�ʱ��������ɵĵ�����Ŀ��n-1����ͬ���������ڴ����ʱ��������ɵĵ�������n+1��������ɵĵ�������10�����ӣ���˵��Ӳ��� ( )
A. K�� B. L�� C. M�� D. N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2��Ϊ��Ҫ��ȼ�Ϻͻ���ԭ�ϣ�����ʮ�ֹ㷺��Ӧ�ã�
��1����֪��C��s��+O2��g��=CO2��g����H1=��393.5kJmol��1C��s��+H2O��g��=CO��g��+H2��g����H2=+131.3kJmol��1
��ӦCO��g��+H2��g��+O2��g��=H2O��g��+CO2��g����H=kJmol��1 ��
��2�����÷�ӦCO��g��+H2��g��+O2��g��=CO2��g��+H2O��g����ƶ��ɵ�MCFSȼ�ϵ������ˮú����CO��H2���ʵ���֮��Ϊ1��1��������ȼ����������CO2�Ļ����Ϊ������ȼ������һ��������Li2CO3��Na2CO3���۵�����������ʵ�һ�����͵�أ����Ը�ȼ�ϵ��Ϊ��Դ����ʯī���缫��ⱥ��NaCl��Һ����Ӧװ���Լ�������ͼ��ʾ�����У�
��ȼ�ϵ�ؼ���Դ��N���ĵ缫��ӦʽΪ��
����֪����ʳ��ˮ�����Ϊ1L��һ��ʱ��������Թ����������Ϊ11.2mL����״�����������ǰ����Һ������仯���Բ��ƣ����ҵ�����Һ��Ͼ��ȣ����ʱ��Һ��pHΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������Ũ����ָ����Һ��һ���ܴ���������ǣ� �� �ټ������ܷų�H2����Һ�У�Al3+��Fe2+��Cl����NO ![]() ��S2��
��S2��
��ʹpH=11����Һ�У�Na+��NO ![]() ��SO
��SO ![]() ��AlO2����S2��
��AlO2����S2��
����ˮ�������c��H+��=10��12mol/L����Һ�У�Na+��NO ![]() ��SO
��SO ![]() ��AlO2����S2��
��AlO2����S2��
����ʹ���۵⻯����ֽ����ɫ����Һ��K+��SO ![]() ��SO
��SO ![]() ��S2����OH��
��S2����OH��
��ʹ���ȱ�����Һ�У�Fe3+��NH4+��Cl����K+��SO42�� ��
A.�ۢ�
B.�ڢ�
C.�ڢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɵ��ԭ����ͼ��ʾ������ܷ�ӦΪZn+2NH4+�TZn2++2NH3��+H2��������˵����ȷ���ǣ� �� 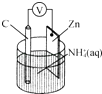
A.̼�缫�Ϸ�����ԭ��Ӧ
B.Zn���Ϸ�����ԭ��Ӧ
C.����п�̸ɵ��Ϊ���ε��
D.�����Ϸ����ķ�ӦΪ2NH4++2e���T2NH3��+H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com