
【题目】ClO2是一种优良的消毒剂,常用于自来水的消毒,其沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。某学习小组在实验室通过反应30NaClO3 +20H2SO4(浓) +7CH3OH = 30ClO2↑+6HCOOH +10Na3H(SO4)2 + CO2↑+23H2O制备ClO2,并将其转化为便于运输和贮存的NaClO2固体,实验装置如下图所示。请回答下列问题:

(1)试剂X的名称为________________;盛放该试剂的仪器的名称为_____________。
(2)实验过程中需持续通入一定量的CO2,其目的是__________________;反应结束后需再通入一定量的CO2,其目的是_________________________。
(3)装置C中生成NaClO2的离子方程式为________________________________。
(4)设计实验证明NaClO2溶液具有氧化性:__________________________。(可供选的试剂:稀HNO3、稀H2SO4、K2SO3溶液、BaCl2、FeCl2溶液、KSCN溶液)
(5)上述装置存在一处明显的缺陷,其改进措施为_____________________________。
(6)某同学欲测定经ClO2消毒过的自来水中ClO2残留量,他进行了如下实验:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.向锥形瓶中加入20.00mL自然水;
Ⅲ.用0.1000mol·L-1 Na2S2O3溶液测定锥形瓶中生成I2的量(I2+2S2O32-=2I-+S4O62-),共用去amLNa2S2O3溶液。
①盛放Na2S2O3溶液的仪器为___________(填“酸式”或“碱式”)滴定管。
②水样中ClO2的含量为____________g/L。
【答案】浓硫酸 分液漏斗 使ClO2中混有一定量的CO2,防止ClO2浓度过高易发生爆炸 需将装置中残留的ClO2吹入装置C中参与反应,提高原料的利用率 2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O 向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性 接一个装有NaOH溶液的洗气瓶进行尾气处理 碱式 0.0675a
+2H2O 向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性 接一个装有NaOH溶液的洗气瓶进行尾气处理 碱式 0.0675a
【解析】
本题考查物质制备的知识。根据ClO2的制备原理和性质及装置图分析,A为制取CO2的装置,B为制取NaClO2装置,C为制取ClO2装置。根据ClO2浓度过大而发生爆炸的性质,选择A制取CO2通入降低ClO2的浓度,为了提高原料的利用率,需将装置中残留的ClO2吹入装置C中参与反应。因为ClO2有毒,要进行尾气处理。
(1)液体试剂混合时,应将密度大的液体加入到密度小的液体中,联系浓硫酸稀释时要做到“酸入水”,故试剂X的名称为浓硫酸;盛放浓硫酸的仪器为分液漏斗。答案:浓硫酸;分液漏斗。
(2) ClO2浓度较高时易发生爆炸,故实验过程中需持续通入一定量的CO2;反应结束后,为提高原料的利用率,需将装置中残留的ClO2吹入装置C中参与反应。答案:使ClO2中混有一定量的CO2,防止ClO2浓度过高易发生爆炸;需将装置中残留的ClO2吹入装置C中参与反应,提高原料的利用率。
(3)装置C中发生ClO2与H2O2在碱性条件下反应生成NaClO2和氧气,化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+O2![]() +2H2O,离子方程式为:2OH-+2ClO2+H2O2=2ClO2-+O2
+2H2O,离子方程式为:2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O;答案:2OH-+2ClO2+H2O2=2ClO2-+O2
+2H2O;答案:2OH-+2ClO2+H2O2=2ClO2-+O2![]() +2H2O;。
+2H2O;。
(4)向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性;答案:向FeCl2和KSCN的混合溶液中加入NaClO2溶液溶液,如果溶液变红,证明NaClO2溶液具有氧化性;也可以向淀粉-KI溶液中加入NaClO2溶液,如果变蓝,说明NaClO2溶液具有氧化性;
(5)上述装置存在一处明显的缺陷是缺少尾气处理装置,其改进措施是在C后接一个装有NaOH溶液的洗气瓶,吸收未参与反应的ClO2;答案:接一个装有NaOH溶液的洗气瓶进行尾气处理。
(6)①因为Na2S2O3溶液显碱性,所以应用碱式滴定管装Na2S2O3溶液。答案:碱式。
②根据电子守恒确定关系式为10S2O32-![]() I2
I2![]() 2ClO2
2ClO2![]() 消耗0.1000mol·L-1 Na2S2O3溶液amL则消耗n(ClO2)=2a
消耗0.1000mol·L-1 Na2S2O3溶液amL则消耗n(ClO2)=2a![]() 10-5mol,水样中ClO2的含量为=(2a
10-5mol,水样中ClO2的含量为=(2a![]() 10-5mol
10-5mol ![]() 67.5g/mol
67.5g/mol![]() =6.75
=6.75![]() 10-2ag/L=0.0675ag/L。答案:0.0675a 。
10-2ag/L=0.0675ag/L。答案:0.0675a 。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是( )

A.浓硫酸B.NaOH溶液C.水D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 1mol乙酸乙酯在稀硫酸中水解生成的乙醇分子中含共价键数目为8NA
B. 18.0g葡萄糖和果糖的混合物中含羟基数目为0.5NA
C. 1L0.5mol·L-1 CuSO4溶液清除P4完全反应生成Cu、H2SO4和H3PO4时转移电子数为2.5NA
D. 标准状况下,2.24LD2和H2的混合气体中含中子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A 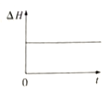 B
B 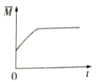 C
C  D
D 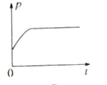
④40min时,改变的条件可能是_______________________________(写2点)。
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |
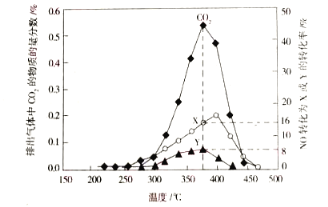
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B. Y的起始浓度不能为零,平衡浓度也不能为零
C. 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动
D. 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如表提供的数据可知,在溶液中能大量共存的微粒组是

A. H2CO3 、HCO3-、CH3COO-、CN-
B. CO32-、 HCO3-、CH3COOH、CN-
C. HCO3-、CH3COO-、CN-、HCN
D. HCN 、HCO3-、CN-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示.AG=![]() ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱 B. A点溶液c(Cl)=c(R+)
C. 若b=10时,AG<0 D. 若b=15,溶液中存在c(Cl-)+c(OH-)=c(R+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com