
| ||
| ||
 ;
; .
.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| A、VA=0.5mol/L?s |
| B、VB=0.6mol/L?s |
| C、VC=0.8mol/L?s |
| D、VD=2mol/L?min |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-720kJ/mol |
| B、+430kJ/mol |
| C、-450kJ/mol |
| D、-1220kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,14 g N2含有的分子数为0.5NA |
| B、0.1mol/L的NaOH溶液中含钠离子数为0.1NA |
| C、6.72L NO2与足量H2O反应,转移的电子数为0.1NA |
| D、0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H2CO3+OH- |
| B、CH3COONa?CH3COO-+Na+ |
| C、Ca(OH)2?Ca2++2OH- |
| D、NH3?H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | CO | Al2O3 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
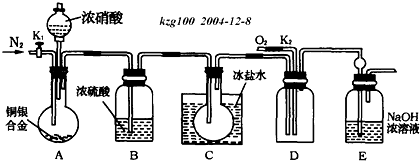
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
| 16n(H2O2) |
| m(样品) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com