
 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).| 4.4g |
| 44g/mol |
| 12.6g |
| 126g/mol |
| 4.4g |
| 44g/mol |
| 12.6g |
| 126g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2 |
| 红磷(少量) |



| NaOH/C2H5OH |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
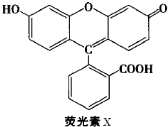
| A、1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH |
| B、1molX最多能与9mol氢气反应 |
| C、X与足量的浓溴水反应,最多消耗4molBr2 |
D、X能与糠醛(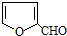 )发生缩聚反应 )发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性Y小于X |
| B、X与Y形成化合物时,X显负价,Y显正价 |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )| A、通入CO2后,不能确定A烧杯中的溶质 |
| B、B烧杯中通入的CO2体积为448mL |
| C、原NaOH溶液的浓度为0.2mol/L |
| D、通入CO2后,C烧杯中溶质成分为NaOH和Na2CO3,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
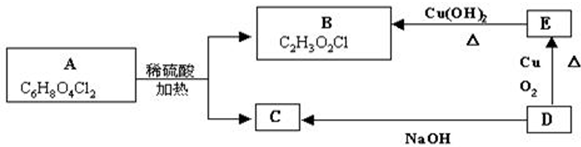
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com