
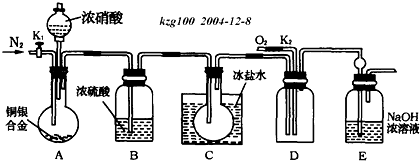


科目:高中化学 来源: 题型:
 某物质只含C、H、O三种元素,其分子模型如右图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等).
某物质只含C、H、O三种元素,其分子模型如右图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直接排放含磷生活污水 |
| B、大量使用氟里昂作为冰箱制冷剂 |
| C、使用可降解塑料代替不可降解塑料 |
| D、使用不易分解的有机氯农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
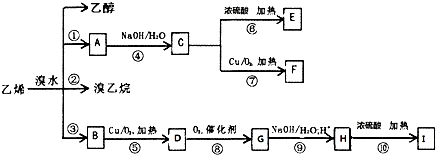
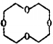 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
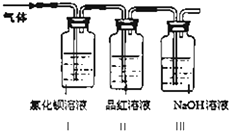
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2 |
| 红磷(少量) |



| NaOH/C2H5OH |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性Y小于X |
| B、X与Y形成化合物时,X显负价,Y显正价 |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com