
【题目】现有短周期主族元素X,Y,Z,R,T;R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( ) 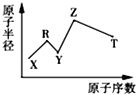
A.原子半径和离子半径均满足:Y<Z
B.最高价氧化物对应的水化物的酸性:T<R
C.气态氢化物的稳定性:Y>T
D.由X,Y,Z,T四种元素组成的化合物水溶液一定呈中性
【答案】C
【解析】解:短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2 , 则Y为O,Z为Na;Z与T形成的Z2T化合物,则T应为S,X的原子半径最小,原子序数最小,则X为H元素.
A.原子半径O>Na,离子半径O2﹣>Na+ , 故A错误;
B.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故B错误;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C正确;
D.由H、C、O、Na四种元素组成的化合物不仅仅为NaHCO3 , 可能为有机盐且含有羧基,溶液不一定为碱性,可能为酸性,故D错误.
故选C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【2016年普通高等学校招生全国统一考试(新课标Ⅱ卷)】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中对应关系正确的是( )
A | ① | 均为加成反应 |
B | ①CH3CH3+Cl2 | 均为取代反应 |
C | ① | 均为加聚反应 |
D | ①C(s)+CO2(g)═2CO(g) | 均为△H>0的反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等. 
(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2 , Na2O2的电子式为 .
(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是 .
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
质量分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
填写表中缺少的内容:Ⅱ;Ⅲ;Ⅳ .
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的极(选填:“正”或“负”);纳米棒向(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O﹣O键和氧气中的O=O键所需的能量依次分别为142kJmol﹣1、497.3kJmol﹣1 . 则反应2H2O2(l)═2H2O(l)+O2(g)△H=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物命名正确且与2,2-二甲基丁烷互为同分异构体的是
A. 2-乙基丁烷 B. 3-甲基戊烷 C. 3,3-二甲基丁烷 D. 3-乙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁时有如下副反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)ΔH〉0,该反应能正向自发进行的原因________。某温度时,把Fe和CO2放入体积固定的密闭容器中, CO2的起始浓度为2.0 mol·L-1,达到平衡后, CO的浓度为1.0 mol·L-1,则该温度下上述反应的平衡常数K=_______。再通入一定量的CO,则CO2的物质的量分数将_______。(填增大、减少或不变)若已知该反应的逆反应速率随时间变化的关系如下图,t1-升温,t2-达到平衡,请在图上画出t1-t3时的v逆)的变化曲线______
FeO(s)+CO(g)ΔH〉0,该反应能正向自发进行的原因________。某温度时,把Fe和CO2放入体积固定的密闭容器中, CO2的起始浓度为2.0 mol·L-1,达到平衡后, CO的浓度为1.0 mol·L-1,则该温度下上述反应的平衡常数K=_______。再通入一定量的CO,则CO2的物质的量分数将_______。(填增大、减少或不变)若已知该反应的逆反应速率随时间变化的关系如下图,t1-升温,t2-达到平衡,请在图上画出t1-t3时的v逆)的变化曲线______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见四种有机物的比例模型示意图.下列说法正确的是( ) 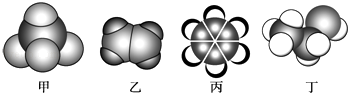
A.甲能使酸性高锰酸钾溶液褪色
B.乙可与溴水发生加成反应使溴水褪色
C.丙与溴水可以发生取代反应
D.丁在稀硫酸作用下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 氯气通入水中:Cl2+H2O2H++Cl﹣+ClO﹣
B. 氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. NaAlO2溶液中通入过量CO2:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D. 用稀硝酸除去试管内壁银:3Ag+4H++NO3﹣=3Ag++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com