
【题目】【2016年普通高等学校招生全国统一考试(新课标Ⅱ卷)】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
【答案】(1)MnO2+e—+H+=MnOOH;Zn+2MnO2+2H+=Zn2++2MnOOH (2)0.05g
(3)加热浓缩、冷却结晶;碳粉、MnOOH;在空气中加热;碳粉转变为CO2,MnOOH氧化为MnO2 (4)Fe3+;2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近
【解析】(1)酸性锌锰干电池是一种一次电池,外壳为金属锌,锌是活泼的金属,锌是负极,电解质显酸性,则负极电极反应式为Zn—2e—=Zn2+。中间是碳棒,碳棒是正极,其中二氧化锰得到电子转化为MnOOH,则正极电极反应式为MnO2+e—+H+=MnOOH,所以总反应式为Zn+2MnO2+2H+=Zn2++2MnOOH。
(2)维持电流强度为0.5A,电池工作五分钟,则通过的电量是0.5×300=150,因此通过电子的物质的量是![]() ,锌在反应中失去2个电子,则理论消耗Zn的质量是
,锌在反应中失去2个电子,则理论消耗Zn的质量是![]() 。
。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵。根据表中数据可知氯化锌的溶解度受温度影响较大,因此两者可以通过结晶分离回收,即通过蒸发浓缩、冷却结晶实现分离。二氧化锰、铁粉、MnOOH均难溶于水,因此滤渣的主要成分是二氧化锰、碳粉、MnOOH。由于碳燃烧生成CO2,MnOOH能被氧化转化为二氧化锰,所以欲从中得到较纯的二氧化锰,最简便的方法是在空气中灼烧。
(4)双氧水具有强氧化性,能把铁氧化为铁离子,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁。根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶液中铁离子浓度为10—5mol/L,则溶液中氢氧根的浓度=![]() ,所以氢离子浓度是2×10—3mol/L,pH=2.7,因此加碱调节pH为2.7时铁刚好完全沉淀。Zn2+浓度为0.1mol/L,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为=
,所以氢离子浓度是2×10—3mol/L,pH=2.7,因此加碱调节pH为2.7时铁刚好完全沉淀。Zn2+浓度为0.1mol/L,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为=![]() =10—8mol/L,氢离子浓度是10—6mol/L,pH=6,即继续加碱调节pH为6时锌开始沉淀。如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开Zn2+和Fe2+。
=10—8mol/L,氢离子浓度是10—6mol/L,pH=6,即继续加碱调节pH为6时锌开始沉淀。如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开Zn2+和Fe2+。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( ) 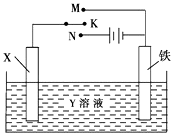
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系.A的产量是衡量一个国家石油化工生产水平的标志;D能使石蕊试液变红;E是不溶于水且具有水果香味的无色液体,相对分子质量是C的2倍;F是塑料的主要成分之一,常用于制食品包装袋.结合如图关系回答问题:
(1)按要求回答下列问题:
①写出A、E的结构简式:A、E;
②写出B、C、D、E中官能团的名称:B、C、 DE、;
③写出反应②的反应方程式:
(2)A与苯都是石油化工的重要产品,在一定条件下A可以转化生成苯,按要求回答下列问题:
①苯可以发生取代反应,写出由苯制备溴苯的化学反应方程式:
②纯净的溴苯是无色油状液体,实验室制得的粗溴苯通常因溶解了Br2呈褐色,可以加入试剂除去,反应方程式为 , 该除杂操作所必须的主要玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是制造化肥和生产其他化工产品的原料,由氨生产的四种化工产品的说法不正确的是( ) 
A.H2NCH2COOH是一种氨基酸
B.CO(NH2)2与NH4CNO性质相同
C.聚丙烯腈的单体为:CH2═CHCN
D.依据酸碱质子理论,HCO3﹣属于酸碱两性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2 ![]() 2SO3。
2SO3。
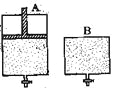
则下列描述正确的是
A.达到平衡所需要的时间:A容器更短
B.达到平衡时:B容器中SO3的转化率更大
C.达到平衡时:A容器中SO2的物质的量更多
D.达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题】 图1为光伏并网发电装置示意图。图2为电解尿素[CO(NH2)2]的碱性溶液制氢装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

图1 光伏并网发电装置 图2 电解尿素的碱性溶液制氢装置
下列叙述中正确的是( )
A. 图1中N型半导体为正极,P型半导体为负极
B. 图2溶液中电子从B极流向A极
C. X2为氧气
D. 工作时,A极的电极反应式为CO(NH2)2 + 8OH- - 6e- = CO32- + N2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种乙醇燃料电池原理如图所示,有关说法正确的是( ) 
A.燃料电池能量转化率比乙醇燃烧发电低
B.电池工作时,电极a上产生淡蓝色火焰
C.电子由电极a经“聚合电解质”流向电极b
D.电池反应为:C2H5OH+3O2→2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA表示阿伏伽德罗常数) ( )
A. 28g N2所含有的原子数为NA
B. 18g的NH4+ 离子中含有电子数11NA
C. 22.4LCH4的质量与NA个甲烷分子的质量之和相等
D. 标准状况下,22.4LCH4和O2的混合气体所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X,Y,Z,R,T;R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( ) 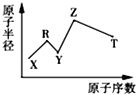
A.原子半径和离子半径均满足:Y<Z
B.最高价氧化物对应的水化物的酸性:T<R
C.气态氢化物的稳定性:Y>T
D.由X,Y,Z,T四种元素组成的化合物水溶液一定呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com