
 ,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为
,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为 ,
, ;
; ;
;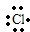 →
→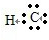 ,CaBr2是离子化合物,形成过程为:
,CaBr2是离子化合物,形成过程为: +?Mg?+
+?Mg?+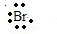 →
→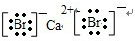 ;
;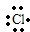 →
→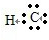 ;
; +?Mg?+
+?Mg?+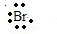 →
→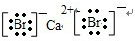 .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是( )
将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是( )| A、Cd作负极,Co作正极 |
| B、原电池工作时,电子从负极沿导线流向正极 |
| C、根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移 动 |
| D、甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.2mol/L |
| B、4mol/L |
| C、5mol/L |
| D、6.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、常温常压下,28g乙烯和丙烯的混合气体中含有碳原子的数目为2NA |
| D、0.1mol Cl2与足量铁粉反应转移电子的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com