
已知化学反应N2+ O2=2NO的能量变化如图所示,判断下列叙述中正确的是( )

A.该反应为放热反应
B.该反应每生成2 mol NO,吸收b kJ热量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应吸收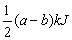 热量时,参加反应的O2为0.5 mol
热量时,参加反应的O2为0.5 mol
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
下列各组离子能够大量共存的是( )
A. pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B. 能与铝反应生成氢气的溶液中:K+、HC03-、Cl-、S2-
C. 使pH试纸显蓝色的溶液中:cu2+、Fe3+、N03-、SO42-
D.在A1C13溶液中:Na+、[Al(OH)4]-、SO42- 、N03- ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的说法错误的是
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性:H2SO3>H2SO4 D.还原性: S2->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______。
a . 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是______。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
 反应A:
反应A:
已知:
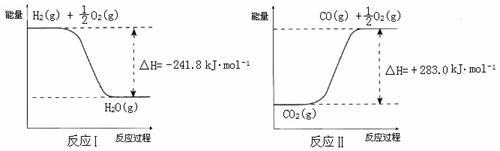
① 反应Ⅱ是_____反应(填“吸热”或“放热”),其原因是
② 反应A的热化学方程式是__
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
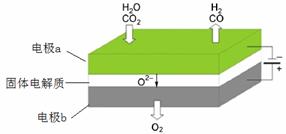
① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是______。
(5)CO与H2在高温下合成C5H12(汽油的一种成分)减少碳排放。已知燃烧1 mol C5H12(g)生成H2O(g)放出约3540 kJ的热量。根据化学平衡原理,说明提高合成C5H12的产率可采取的措施是___ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是( )
A.Ⅰ为醋酸稀释时pH变化曲线
B.溶液的导电性:b>a>c
C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸
D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能证明HNO2是弱电解质的是( )
A. 用HNO2溶液做导电性试验灯光较暗
B. HNO2是共价化合物
C.常温下,0.1 mol/L HNO2溶液的pH为2.2
D. HNO2溶液不与NaCl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,共放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则1mol C与O2反应生成CO的反应热△H为:(单位:kJ•mol﹣1)
A.-y ; B.-(10x﹣y); C.-(5x-0.5y); D.+(10x﹣y)
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为aL,则a的取值范围是 。
(3)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO)︰V(H2)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com