
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  ��H1
��H1 CH3OH(g) ��H2
CH3OH(g) ��H2 ��
�� ƽ�ⳣ��(K)
ƽ�ⳣ��(K) | �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
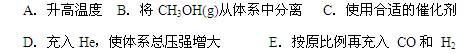

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
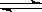 CO2��g����H2(g) ��K��1.0������Ӧ��ʼʱCO��H2O��Ũ�ȷֱ�Ϊ0.20mol/L��1.00mol/L����COת��ΪCO2��ת����Ϊ
CO2��g����H2(g) ��K��1.0������Ӧ��ʼʱCO��H2O��Ũ�ȷֱ�Ϊ0.20mol/L��1.00mol/L����COת��ΪCO2��ת����Ϊ| A��80% | B��83% | C��75% | D��91% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
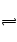 10Ca2+(aq)+6PO43-(aq)+2OH-(aq)����֪25��ʱKsp[Ca10(PO4)6(OH)2]="2.35" ��10-59�� Ksp[Ca10(PO4)6F2]=7.1�� 10-61��Ksp[CaCO3]="5" ��10-9��Ksp[CaF2]=4��10-11������˵������ȷ�ǣ� ��
10Ca2+(aq)+6PO43-(aq)+2OH-(aq)����֪25��ʱKsp[Ca10(PO4)6(OH)2]="2.35" ��10-59�� Ksp[Ca10(PO4)6F2]=7.1�� 10-61��Ksp[CaCO3]="5" ��10-9��Ksp[CaF2]=4��10-11������˵������ȷ�ǣ� ��| A����ǻ�ڲ���ʳ��ᷢ��ʹ��ǻ�����ԣ����Է���˯ǰӦ��Ҫ���� |
| B������ˮ�з�Ԫ�غ����ϵ͵ĵ���ʹ�ú����������Ч��ֹȣ�� |
| C��25��ʱ����CaCO3��Һ�ͱ���CaF2��Һ��ȣ�����c(Ca2��)�ϴ� |
| D��25��ʱ����CaCO3����Һ�м���NaF��Һ��CaCO3������ת��ΪCaF2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����ˮ����ƽ�⣺Cl2+H2O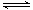 HCl+HClO��������AgNO3��Һ����Һ��ɫ��dz�� HCl+HClO��������AgNO3��Һ����Һ��ɫ��dz�� |
B����CO(g)+NO2(g)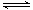 CO2(g)+NO(g)��ƽ����ϵ����ѹǿ��ʹ��ɫ��� CO2(g)+NO(g)��ƽ����ϵ����ѹǿ��ʹ��ɫ��� |
| C�������¶��ܹ��ٽ�ˮ�ĵ��� |
| D��SO2��������SO3�ķ�Ӧ��������������Ŀ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����( )
3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����( ) �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
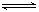 SO3(g)+NO(g���Ŀ��淴Ӧ��������˵����Ӧ�ﵽƽ��״̬���ǣ� ��
SO3(g)+NO(g���Ŀ��淴Ӧ��������˵����Ӧ�ﵽƽ��״̬���ǣ� ��| A����ϵѹǿ���ֲ��� | B�����������ɫ���ֲ��� |
| C��SO3��NO������ȱ��ֲ��� | D��ÿ����1 mol SO3��ͬʱ����1 mol NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe3O4(s)��4H2(g)����Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ(����)
Fe3O4(s)��4H2(g)����Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ(����)| A��K�� | B��K�� | C��K�� | D��K�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3��g��
2NH3��g���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com