
【题目】NH3可用于制氮肥![]() 尿素、碳铵等
尿素、碳铵等![]() 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为________________。联氨的电子式为________________。
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,则反应2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g)的H=________,该反应的平衡常数表达式为________________,在常温下该反应________(填“能”或“不能”)自发进行。为了提高N2H4的产率,下列措施可行的是____________________。
A.增加H2O(l)的量B.增大压强C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入________________,阴极通入________________,阴极的电极反应式为________________。
【答案】NaClO+2NH3=NaCl+N2H4+H2O ![]() +716.4kJ/mol
+716.4kJ/mol 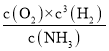 不能 D H2 N2 N2+6H++6e-=2NH3
不能 D H2 N2 N2+6H++6e-=2NH3
【解析】
(1)NaClO氧化NH3得到N2H4,N元素化合价由-3升为-2,Cl元素化合价由+1降为-1,根据得失电子守恒写出反应的化学方程式为NaClO+2NH3=NaCl+N2H4+H2O,联氨的电子式为![]() ;
;
(2)根据盖斯定律计算;平衡常数表达式K=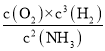 ;根据综合判据判断反应方向;
;根据综合判据判断反应方向;
A.在常温下,氨气和水反应生成氨水,增加H2O(l)的量,平衡不移动,N2H4的产率不变;
B.反应体系中,反应物气体的计量数小于生成物气体计量数的和,则增大压强平衡逆向移动,N2H4的产率降低;
C.该反应为吸热反应,降低温度,平衡逆向移动,N2H4的产率降低;
D.及时导出O2,平衡向正反应方向移动,N2H4的产率升高;
(3)电解法合成氨,阳极发生氧化反应,应通入氢气,阴极发生还原反应,应通入氮气。
(1)NaClO氧化NH3得到N2H4,N元素化合价由-3升为-2,Cl元素化合价由+1降为-1,根据得失电子守恒写出反应的化学方程式为NaClO+2NH3=NaCl+N2H4+H2O,联氨的电子式为![]() ;
;
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g) ③,根据盖斯定律③=-(①+②) H=92.4+624=+716.4 kJ/mol;
平衡常数表达式K=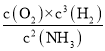 ;
;
该反应为熵增的吸热反应,H>0,S>0,则在常温下,H-TS>0,反应不能自发进行;
A.在常温下,氨气和水反应生成氨水,增加H2O(l)的量,平衡不移动,N2H4的产率不变,A错误;
B.反应体系中,反应物气体的计量数小于生成物气体计量数的和,则增大压强平衡逆向移动,N2H4的产率降低,B错误;
C.该反应为吸热反应,降低温度,平衡逆向移动,N2H4的产率降低,C错误;
D.及时导出O2,平衡向正反应方向移动,N2H4的产率升高,D正确;
答案为D;
(3)电解法合成氨,阳极发生氧化反应,应通入氢气,阴极发生还原反应,应通入氮气,阴极的电极反应方程式为N2+6H++6e-=2NH3。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把8.0g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体2.4g,产生NO2和NO的混合气体0.12mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.6.0mol·L-1B.7.0mol·L -1C.8.0mol·L -1D.9.0mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示过程除去 AlCl3溶液中含有的 Mg2+、K+ 杂质离子并尽可能减小 AlCl3 的损失。下列说法正确的是
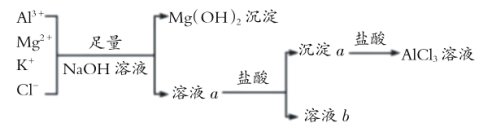
A.NaOH 溶液可以用Ba(OH)2溶液来代替B.溶液a中含有 Al3+、K+、Cl-、Na+、OH-
C.溶液 b 中只含有 NaClD.向溶液a和沉淀a中滴加盐酸都要过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)化合物N2H4的电子式为___________________。
(2)As原子的核外电子排布式为_______________________。
(3)P和S是同一周期的两种元素,P的第一电离能比S大,原因是_______________。
(4)NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是_________________。
(5)Na3AsO4中含有的化学键类型包括________;AsO43-空间构型为________,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是________________。

(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为_________,该晶体的密度为_______g·cm-3(用含NA、a的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应
B. 根据图示,物质A为CO2
C. 为增强污水的导电能力,可向污水中加入适量乙醇
D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍。
A | ||
B | C |
(1)A、B、C的元素名称分别为A______、B______、C_____。
(2)A的原子结构示意图为________。
(3)B在元素周期表中的位置是_______,B最高价氧化物的化学式为______。
(4)A的简单氢化物分子式为_______;B、C的最高价氧化物水化物的分子式分别为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有果香味,现用A合成聚酯L,过程如下图所示。
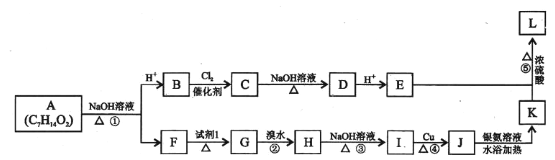
已知:(1)有机物B和F的相对分子质量相等,H有支链。
(2)已知:![]()
回答下列问题:
(I)试剂I的名称是____________________________。
(2)请用系统命名法给有机物H命名,其名称是_________________________。
(3) ①、②、③、④、⑤中属于取代反应的是___________________(填标号)。
(4)有机物F的结构简式可能是_______________________________。
(5) C生成D的化学方程式是______________________________。
(6) J生成K的化学方程式是______________________________。
(7)有机物E在浓硫酸的作用下,可生成一种6元环状化合物,该环状化合物的等效氢有_____种。
(8)有机物M是E的同系物,M的相对分子质量比E大14。满足下列条件的与M具有相同分子式的同分异构体共有_____种(不考虑立体异构)。
①能发生水解反应 ②能与金属钠反应 ③不含![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com