
【题目】A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍。
A | ||
B | C |
(1)A、B、C的元素名称分别为A______、B______、C_____。
(2)A的原子结构示意图为________。
(3)B在元素周期表中的位置是_______,B最高价氧化物的化学式为______。
(4)A的简单氢化物分子式为_______;B、C的最高价氧化物水化物的分子式分别为____、____。
【答案】氧 磷 氯 ![]() 第三周期ⅤA族 P2O5 H2O H3PO4 HClO4
第三周期ⅤA族 P2O5 H2O H3PO4 HClO4
【解析】
由于A、B、C均为短周期元素,A应为第二周期元素,B、C为第三周期元素。设A的原子序数为x,B位于A下一周期的前一个主族,C位于A下一周期的后一个主族。由于第二、三周期同主族元素原子序数相差8,因此B的原子序数为x+8-1=x+7,C的原子序数为x+8+1=x+9。根据B、C两元素原子序数之和是A元素的原子序数的4倍,可得下式:4x=x+7+x+9,得x=8。则A原子序数为8,B原子序数为15,C原子序数为17,所以A为O元素,B为P元素,C为Cl元素。
(1)根据分析可知A为氧、B为磷、C为氯;
(2)A为O元素,O原子的结构示意图为![]() ;
;
(3)P元素位于第三周期ⅤA族;P元素的最高正价为+5价,相应的氧化物为P2O5;
(4)O元素的简单氢化物为H2O;P元素最高价氧化物的水化物为H3PO4;Cl元素最高价氧化物的水化物为HClO4。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵结构相似。已知NH4H与水反应有氢气产生,则下列叙述不正确的是
A.NH4H的电子式是:
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大
D.NH4H溶于水后,形成的溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于制氮肥![]() 尿素、碳铵等
尿素、碳铵等![]() 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为________________。联氨的电子式为________________。
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,则反应2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g)的H=________,该反应的平衡常数表达式为________________,在常温下该反应________(填“能”或“不能”)自发进行。为了提高N2H4的产率,下列措施可行的是____________________。
A.增加H2O(l)的量B.增大压强C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入________________,阴极通入________________,阴极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备沉淀Fe(OH)2
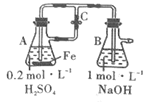
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
D.FeCl3溶液中滴加KSCN溶液会生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
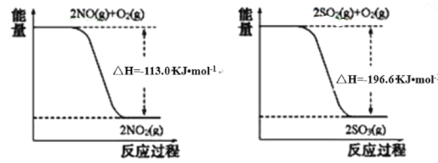
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
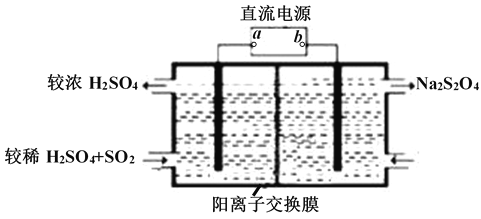
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
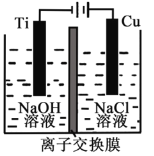
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
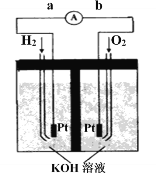
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间的化学反应,反应产物一定为纯净物的是
A.CH3CH3+Cl2![]()
B.CH3-CH=CH-CH3+Br2
C.CH2=CH-CH2-CH3+HCl![]()
D.CH3-CH=CH2+H2O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价层电子排布式为___。
(2)硝酸钾中NO3-的空间构型为___。
(3)1molCO2分子中含有σ键的数目为___。乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是___。
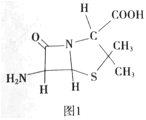
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有___。
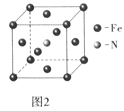
(5)铁和氨气在640℃可发生置换反应,产物之-的晶胞结构如图2所示,写出该反应的化学方程式___。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
,![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
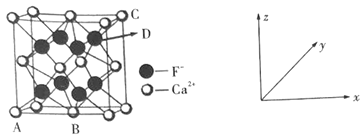
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为ρg·cm-3,则晶胞参数a为___pm(设NA为阿伏加德罗常数的值,用含ρ、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,![]() 不变
不变
B.常温下,0.01mol·L-1Ba(OH)2溶液pH为12
C.常温下,CH3COOH稀溶液中加水稀释,则![]() 减小
减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且![]() 的值增大
的值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com