
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价层电子排布式为___。
(2)硝酸钾中NO3-的空间构型为___。
(3)1molCO2分子中含有σ键的数目为___。乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是___。
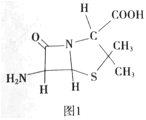
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有___。
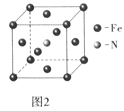
(5)铁和氨气在640℃可发生置换反应,产物之-的晶胞结构如图2所示,写出该反应的化学方程式___。
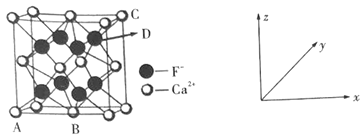
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
,![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为ρg·cm-3,则晶胞参数a为___pm(设NA为阿伏加德罗常数的值,用含ρ、NA的式子表示)。
【答案】3d64s2 平面正三角形 2 乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高 C、N、O、S 8Fe+2NH3=2Fe4N+3H2 (3/4,3/4,3/4) 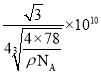
【解析】
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)根据价层电子对互斥理论确定离子空间构型;
(3)依据二氧化碳的结构进行回答;
(4)根据价层电子对互斥理论确定碳原子杂化方式;
(5)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式.
(6)①D处于体对角线AC上,且AD距离等于体对角线长度的![]() ,则D到坐标平面距离均为晶胞棱长
,则D到坐标平面距离均为晶胞棱长![]() ;
;
②晶胞中Ca2+与离它最近的F-之间的距离等于晶胞体对角线长度的![]() ,体对角线长度等于晶胞棱长的√3倍,均摊法计算晶胞中各原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
,体对角线长度等于晶胞棱长的√3倍,均摊法计算晶胞中各原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2,
故答案为:3d64s2;
(2)NO3-中N原子价层电子对=1/2(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,
故答案为:平面正三角形;
(3)二氧化碳的结构是O=C=O,含有的σ键的数目为2,乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,;
故答案为:2;乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高;
(4)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,
故答案为:C、N、O、S;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3=2Fe4N+3H2,
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3=2Fe4N+3H2,
故答案为:8Fe+2NH3=2Fe4N+3H2.
(6)①D处于体对角线AC上,且AD距离等于体对角线长度的34,则D到坐标平面距离均为晶胞棱长3/4,由C的坐标参数可知,晶胞棱长=1,故D到坐标平面距离均3/4,D处微粒的坐标参数为(![]() ,
, ![]() ,
,![]() ),
),
故答案为:(![]() ,
,![]() ,
,![]() );
);
②设晶胞中Ca2+与离它最近的F-间距离为xnm,晶胞的边长为ycm,则x与y的关系为(4x)2=3y2,所以y=![]() 。由于F-位于晶胞的内部,Ca2+位于晶胞的顶点和面心,所以平均每个晶胞含有F-和Ca2+数目分别是8个和4个,所以ρ=
。由于F-位于晶胞的内部,Ca2+位于晶胞的顶点和面心,所以平均每个晶胞含有F-和Ca2+数目分别是8个和4个,所以ρ=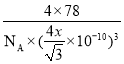 ,解得x=
,解得x=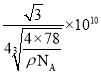 ,
,
故答案为: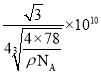 。
。


科目:高中化学 来源: 题型:
【题目】把8.0g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体2.4g,产生NO2和NO的混合气体0.12mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.6.0mol·L-1B.7.0mol·L -1C.8.0mol·L -1D.9.0mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍。
A | ||
B | C |
(1)A、B、C的元素名称分别为A______、B______、C_____。
(2)A的原子结构示意图为________。
(3)B在元素周期表中的位置是_______,B最高价氧化物的化学式为______。
(4)A的简单氢化物分子式为_______;B、C的最高价氧化物水化物的分子式分别为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机方程式书写正确的是
A.苯酚钠溶液中通入少量二氧化碳:![]() +CO2+H2O→
+CO2+H2O→![]() +HCO3-
+HCO3-
B.甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
C.用苯制硝基苯:![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
D.苯乙酮与足量氢气加成: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为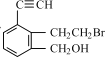 。下列关于该有机物的说法中正确的是
。下列关于该有机物的说法中正确的是
A.能与 HBr 发生取代反应
B.能与 Br2/CCl4 溶液发生加成反应
C.能与 NaOH 的水溶液发生消去反应
D.1 mol 该有机物最多能与 2 mol H2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有果香味,现用A合成聚酯L,过程如下图所示。
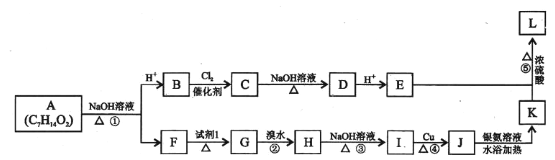
已知:(1)有机物B和F的相对分子质量相等,H有支链。
(2)已知:![]()
回答下列问题:
(I)试剂I的名称是____________________________。
(2)请用系统命名法给有机物H命名,其名称是_________________________。
(3) ①、②、③、④、⑤中属于取代反应的是___________________(填标号)。
(4)有机物F的结构简式可能是_______________________________。
(5) C生成D的化学方程式是______________________________。
(6) J生成K的化学方程式是______________________________。
(7)有机物E在浓硫酸的作用下,可生成一种6元环状化合物,该环状化合物的等效氢有_____种。
(8)有机物M是E的同系物,M的相对分子质量比E大14。满足下列条件的与M具有相同分子式的同分异构体共有_____种(不考虑立体异构)。
①能发生水解反应 ②能与金属钠反应 ③不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1 ②1∶1∶2 ∶6 ③3∶2 ④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①_______________________________; ②______________________________;
③_______________________________; ④______________________________。
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
需加入的试剂 | 分离装置 | |
乙烷(乙烯) | __________________ | __________________ |
乙醇(乙酸) | __________________ | __________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷重整时涉及以下两个反应
① CH4(g) + H2O(g) ![]() CO(g) +3H2(g) 平衡常数K1
CO(g) +3H2(g) 平衡常数K1
② CO (g) + H2O(g) ![]() CO2(g) + H2(g) 平衡常数K2
CO2(g) + H2(g) 平衡常数K2
它们的平衡常数随温度的变化如图所示,下列说法正确的是( )

A.反应①、②都是放热反应
B.两曲线交点表示此时①、②两反应速率相等
C.相同温度下,CH4(g)+2H2O(g) ![]() CO2(g) +4H2(g)的平衡常数为K1+K2
CO2(g) +4H2(g)的平衡常数为K1+K2
D.相同条件下,增大反应①、②中水蒸气的浓度,CH4、CO的转化率均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com