
【题目】(1)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1 ②1∶1∶2 ∶6 ③3∶2 ④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①_______________________________; ②______________________________;
③_______________________________; ④______________________________。
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
需加入的试剂 | 分离装置 | |
乙烷(乙烯) | __________________ | __________________ |
乙醇(乙酸) | __________________ | __________________ |
【答案】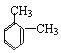
![]()
![]()
![]() ③ C ④ B
③ C ④ B
【解析】
(1)浓硫酸增重质量为水的质量,根据水的质量计算其中含有的H原子的物质的量;氢氧化钠溶液增重的质量为CO2的质量,根据CO2的质量计算其中含有的C原子的物质的量,进而可推算出1mol有机物中含有C、H的物质的量,得到其分子式,根据核磁共振氢谱可知有几种性质不同的H,且知道了原子个数比,以此可确定有机物的分子式,并书写结构简式;
(2)乙烯与溴水反应,而乙烷不能;乙酸与NaOH反应后,增大与乙醇的沸点差异,以此来解答。
(1)浓硫酸增重9g为H2O的质量,则n(H)=2×n(H2O)= 2×![]() =1mol;氢氧化钠溶液增重35.2g为CO2的质量,则n(C)=n(CO2)=
=1mol;氢氧化钠溶液增重35.2g为CO2的质量,则n(C)=n(CO2)=![]() =0.8mol,所以1mol有机物中含有8molC,10molH,则该苯的同系物的分子式为C8H10。
=0.8mol,所以1mol有机物中含有8molC,10molH,则该苯的同系物的分子式为C8H10。
①在PMR谱上峰给出的稳定强度为:3:1:1,即有三种类型的氢原子,个数之比是3:1:1,则为邻二甲苯,结构简式为: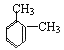 ;
;
②在PMR谱上峰给出的稳定强度为:1:1:2:6,即有4种类型的氢原子,个数之比是1:1:2:6,则为间二甲苯,结构简式为: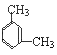 ;
;
③在PMR谱上峰给出的稳定强度为:3:2,即有2种类型的氢原子,个数之比是3:2,则为对二甲苯,结构简式为:![]() ;
;
④在PMR谱上峰给出的稳定强度为:3:2:2:2:1,即有5种类型的氢原子,个数之比是3:2:2:2:1,则为乙苯,结构简式为:![]() ;
;
(2)乙烯与溴水反应,而乙烷不能,则选择试剂为③,分离方法为洗气,即为C;
乙酸与NaOH反应后产生离子化合物CH3COONa,物质的沸点较高,而乙醇是由分子构成的化合物,沸点低,容易气化,乙醇反应后增大与乙醇的沸点差异,可选择试剂为②,分离方法为蒸馏,即为B。


科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价层电子排布式为___。
(2)硝酸钾中NO3-的空间构型为___。
(3)1molCO2分子中含有σ键的数目为___。乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是___。
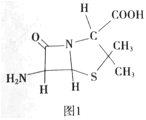
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有___。
(5)铁和氨气在640℃可发生置换反应,产物之-的晶胞结构如图2所示,写出该反应的化学方程式___。
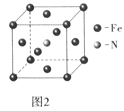
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
,![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
,0);C处为(1,1,1)。则D处微粒的坐标参数为___。
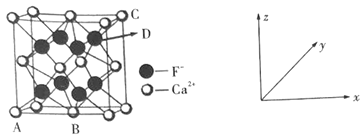
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为ρg·cm-3,则晶胞参数a为___pm(设NA为阿伏加德罗常数的值,用含ρ、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 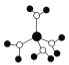 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 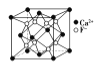 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C21H20O6)在临床医学上具有预防肿瘤的作用,其合成路线如下,其中反应③中反应物的原子利用率为100%。
已知:Ⅰ. ![]()
![]()
![]() +H2O
+H2O
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ. ![]() +
+![]()
![]()
![]() +H2O
+H2O
请回答下列问题:
(1) B中含有的官能团名称是____________。
(2)反应①的化学方程式是____________。 反应④的化学方程式是____________。
(3) F的结构简式是____________。
(4) E的同分异构体中,同时符合下列两个条件的共有__________种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为__________。
①苯环上的一取代物只有2种;
②1mol该物质与足量NaOH溶液反应时,反应消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式书写正确是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.![]()
C.CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,![]() 不变
不变
B.常温下,0.01mol·L-1Ba(OH)2溶液pH为12
C.常温下,CH3COOH稀溶液中加水稀释,则![]() 减小
减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭器中通入![]() 和
和![]() ,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率
,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率![]() 正
正![]() 随时间
随时间![]() 变化的示意图如图所示。由图可得出的正确结论是
变化的示意图如图所示。由图可得出的正确结论是
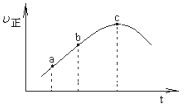
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.逆反应速率:c点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究证明高铁酸钠![]() 是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。高铁酸钠只能在碱性环境中稳定存在。下列是通过次氯酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。高铁酸钠只能在碱性环境中稳定存在。下列是通过次氯酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
Ⅰ![]() 用氯气和氢氧化钠溶液反应制备NaClO溶液
用氯气和氢氧化钠溶液反应制备NaClO溶液
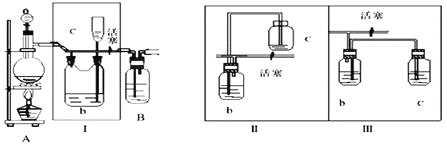
(1)![]() 是氯气发生装置,写出实验室用此装置制取氯气的离子方程式___________。
是氯气发生装置,写出实验室用此装置制取氯气的离子方程式___________。
(2)Ⅰ装置的作用是__________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?___________。简要说明理由_________________________。
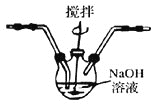
(4)将产生的氯气通入D装置中制NaClO溶液
已知:![]() 为了防止产生
为了防止产生![]() ,除搅拌和混入
,除搅拌和混入![]() 稀释外,还应采取的操作是___________________________。
稀释外,还应采取的操作是___________________________。
Ⅱ![]() 制备
制备![]()
(1)将![]() 溶液加入到NaOH与NaClO的混合溶液中,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品,上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是______________________________。
溶液加入到NaOH与NaClO的混合溶液中,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品,上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是______________________________。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应的化学方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com