
【题目】向20mL含有1mol/L的氯化铝溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的物质的量与所加碱的体积如图所示:
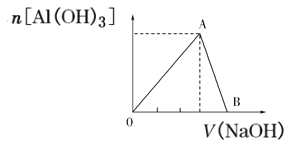
(1)写出OA段和AB段发生反应的离子方程式:OA段_____;AB段_____。
(2)A点溶液中的溶质为:____。(填化学式)
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是____mL或____mL。
(4)B点表示的氢氧化钠溶液的体积是___mL。
【答案】Al3++3OH- =Al(OH)3↓ Al(OH)3+OH- =AlO2-+2H2O NaCl 30mL 70mL 80mL
【解析】
AlCl3溶液中滴加NaOH溶液,Al3++3OH-=Al(OH)3↓,随后生成的沉淀,再溶解,化学方程式为Al(OH)3+OH-=AlO2-+2H2O。
(1)根据分析OA为生成Al(OH)3的阶段,OB段位Al(OH)3溶解的阶段,离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
(2)A点,溶液中的Al3+完全沉淀,溶液中只有Cl-和Na+,则A点溶液中的溶质只有NaCl;
(3)若Al3+完全沉淀,则生成0.02L×1mol·L-1=0.02molAl(OH)3,其质量为0.02mol×78g·mol-1=1.76g,现在产生0.78gAl(OH)3,则有两种情况;
①整个过程中只生成了0.78gAl(OH)3;0.78g Al(OH)3其物质的量为0.01mol,需要消耗0.03molOH-,需要NaOH的体积为0.03mol÷1mol/L=0.03L=30mL;
②Al3+完全沉淀,但是滴入过程的NaOH中,Al(OH)3又溶解了一部分。Al3+完全沉淀,溶液中一共有0.02molAl3+,需要0.06molOH-,共生成0.02molAl(OH)3,再溶解0.01molAl(OH)3,需要0.01molOH-,则整个过程需要0.7molOH-,需要NaOH溶液的体积为0.07mol÷1mol/L=0.07L=70mL;
(4)B点表示的Al3+完全沉淀,沉淀又继续溶解,方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,整个过程的关系式为Al3+~4OH-,溶液中有0.02molAl3+,则需要0.08molOH-,需要NaOH的体积为0.08mol÷1mol/L=0.08L=80mL。


科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
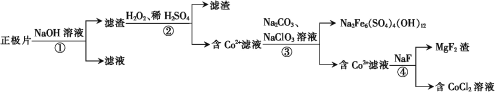
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重晶石(主要成分为BaSO4)制备BaCO3的常用方法有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单表示如下:
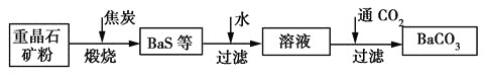
(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为_____________。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是________。
a 加入过量的焦炭,同时通入空气
b 设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是________。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+![]() (aq)BaCO3(s)+
(aq)BaCO3(s)+![]() (aq)
(aq)
①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为_________。
②与高温煅烧还原法相比,沉淀转化法的优点主要有_______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,其中还原剂是___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_____________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____________(填“大于”或“小于”)生成物化学键形成放出的总能量。
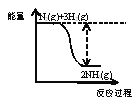
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
a.容器中N2、H2、NH3共存 b.N2、H2、NH3的物质的量之比为1:3:2
c.容器中的压强不随时间变化 d.N2、NH3浓度相等
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_________。
(4)下列各反应中,符合如图所示能量变化的是_____________(填序号)。

a.H2和Cl2的反应 b.Al和盐酸的反应 c.Na和H2O的反应 d.Ba(OH)2·8H2O和NH4C1的反应
(5)海水资源前景广阔。
①列举一种海水淡化的方法______________。
②采用空气吹出法从海水中提取溴的过程中,吸收剂SO2和溴蒸气反应生成氢溴酸以达到富集的目的,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液 B、升华 C、降温结晶 D、分液 E、蒸馏 F、过滤
①____分离饱和食盐水与沙子的混合物;
②____从硝酸钾和氯化钠的混合液中获得硝酸钾;
③____分离水和汽油的混合物;
④____分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃);
⑤____分离出混在沙土中的碘单质。
(Ⅱ)掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。

(1)写出下列仪器的名称:a.___;b___
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由___(填f或g)口通入___(填f或g)流出。
(3)实验时a中除加入少量自来水外,还需加入少量___,其作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸和氢氧化钡溶液反应:Ba2++![]() =BaSO4↓
=BaSO4↓
B.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.少量稀盐酸滴入Na2CO3稀溶液中:![]() +H+=
+H+=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量的聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475g;另一份溶液,先将Fe3+还原为Fe2+,再用0.020mol/LK2Cr2O7标准溶液与之恰好完全反应,消耗K2Cr2O7标准溶液50.00mL。该聚合硫酸铁样品中a:b的比值为
A. 5:4B. 4:5C. 2:1D. 1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com