
����Ŀ���ۺ�������������ˮ�ľ������仯ѧʽ�ɱ�ʾΪ[Fea(OH)b(SO4)c]m��ȡһ�����ľۺ���������Ʒ���������ᷴӦ��������Һƽ����Ϊ���ݡ�һ����Һ�м���������BaCl2��Һ���õ���ɫ����1.7475g����һ����Һ���Ƚ�Fe3+��ԭΪFe2+������0.020mol/LK2Cr2O7����Һ��֮ǡ����ȫ��Ӧ������K2Cr2O7����Һ50.00mL���þۺ���������Ʒ��a:b�ı�ֵΪ
A. 5:4B. 4:5C. 2:1D. 1:2

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL����1mol/L���Ȼ�����Һ����μ���Ũ��Ϊ1mol/L������������Һ���������������ʵ��������Ӽ�������ͼ��ʾ��
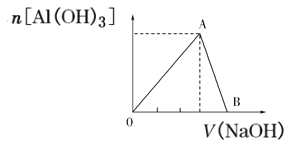
��1��д��OA�κ�AB�η�����Ӧ�����ӷ���ʽ��OA��_____��AB��_____��
��2��A����Һ�е�����Ϊ��____�����ѧʽ��
��3��������0.78g��ɫ����������������������Һ�����������____mL��____mL��
��4��B���ʾ������������Һ�������___mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ4NH3+5O2![]() 4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)(��λ��ΪmolL-1min-1)��ʾ��������ʽ���У���ȷ���ǣ� ��
4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)(��λ��ΪmolL-1min-1)��ʾ��������ʽ���У���ȷ���ǣ� ��
A. 4v(O2)=5v(NO)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O)D. 4v(NH3)=5v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2CO3��NaHCO3��˵���У�����ȷ����
A. ��ɫ��Ӧ��Ϊ��ɫ
B. �ܽ�ȣ�Na2CO3>NaHCO3
C. �����ü��ȵķ�����ȥNa2CO3�����е�NaHCO3����
D. ���ʵ�����ͬ�����ֹ���ֱ����������ᷴӦ��Na2CO3�����Ķ�����̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����������Ӱ�����ǵ������뽡����ij�����������п��ܺ������������е������֣�NH4+��Ba2+��Fe2+��Cl����NO3����CO32����SO42����ijͬѧ�ռ��˸õ���������������Ҫ��Ԥ������õ�������Һ����Ʋ��������ʵ�飺
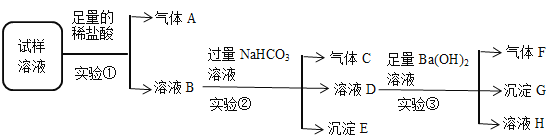
�Իش��������⣺
��1��ʵ����м���ϡ���������ɫ����A���ɣ�����A��������ɺ���ɫ����ҺB��Ȼ���壬����Һ������������䣬�ݴ˿�֪ԭ��Һ��һ������__________________���������ӷ��ţ�
��2��ʵ����з�����Ӧ�����ӷ���ʽΪ_________________________________��
��3������ʵ��������ͬѧ��Ϊԭ��Һ��һ������SO42����������ͬѧ��Ϊ����۲��������ֽ����˺���ʵ��ܣ�����ȷ��ԭ��Һ�к���SO42������д��ʵ��ܿ��еIJ�������������______________________________��
II ������β����CO��NOx�Լ�ȼú�����е�SO2���Ǵ�����Ⱦ������ǵ�����������Ҫ���塣
��4��������ԭ������NOx��ת�����£�
![]()
�ٷ�ӦIΪNO+O3 = NO2+O2�����ɱ�״��11.2 L O2ʱ��ת�Ƶ��ӵ����ʵ�����______mol��
�ڷ�Ӧ���У���n( NO2)��n[CO(NH2)2]=3��2ʱ�����������뻹ԭ�����������Ϊ___________��
��5������SO2��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ���£�CeΪ��Ԫ�أ���
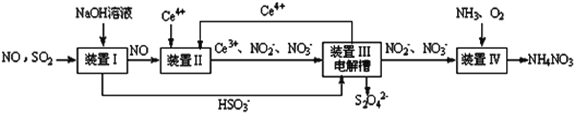
�� װ�â��У�����������NO��Ce4+�����IJ�����Ҫ��NO3-��NO2-����д�����ɵ����ʵ�����NO3����NO2��ʱ�����ӷ���ʽ________________
�� װ�â������֮һ�������ӽ���Ĥ���۵��ʹ��Ce4+������ͬʱ����һ������S2O42-�ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ԭ��Ӧ��������ȷ����( )
A.������ԭ��Ӧ����һ��Ԫ�ر�����ʱ��һ������һ��Ԫ�ر���ԭ
B.ij����Ԫ��M�ɻ���̬��Ϊ����̬��Mһ������ԭ
C.��˫���ű�ʾ���з�Ӧ�ĵ���ת��
D.�ǽ��������ڷ�Ӧ��ֻ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
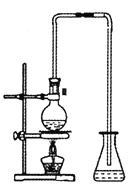
����Ŀ����A��һ��ֲ�������ĵ��ڼ���A������ͼ��ʾ��ת�����Ƶ��й���ζ��Һ��E(C4H8O2)����ش��������⣺
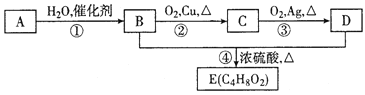
��1��A�ĵ���ʽΪ___��D���������������ŵ�����Ϊ___��
��2����Ӧ�ٵķ�Ӧ������____��
��3��A��һ�������¿��Ծ�����һ�ֳ������ϣ�д�������ϵĽṹ��ʽ___��
��4����д����Ӧ�ڵĻ�ѧ����ʽ__��
��5��ʵ���ҳ���Ӧ���Ʊ��л���E��װ����ͼ�������ܵ������ǵ�����___����ƿ��ʢ�ŵ�Һ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O�㷺�������Ϻͻ��������Ĵ�����
���Ʊ�Cu2O
��1����ⷨ����ҵ����ͭ����������ƬΪ���������һ��Ũ�ȵ�NaOH ��Һ���Ʊ�������ͭ��д�������ĵ缫��ӦʽΪ_____________________
��2����Һ-��ԭ������ 100�� Cu��NO3��2 ��ˮ��Һ�м���һ������� NaOH ˮ��Һ��������ʹ֮��Ͼ��ȣ� ����μ���ˮ���µ�ˮ��Һ��ֱ��������ɫ�����������ˡ�ϴ�Ӻ���ո���õ�Cu2O ��ĩ��
��֪�� N2H4��l��+O2��g��=N2��g��+2H2O��l����H= -akJ/mol
Cu(OH)2��s��=CuO��s��+H2O��l����H= +bkJ/mol
4CuO��s��=2Cu2O��s��+O2��g����H= +ckJ/mol
����N2H4 ��Cu(OH)2 ��Ӧ�Ʊ� Cu2O ���Ȼ�ѧ����ʽΪ ________________________��
��ҵ����Cu2O �� ZnO ��ɵĴ��������ڹ�ҵ�Ϻϳɼ״��� CO(g)+2H2(g)![]() CH3OH(g) ��H = -90.8 kJ/mol���ش��������⣺
CH3OH(g) ��H = -90.8 kJ/mol���ش��������⣺
��1����˵����ӦCO(g)+2H2(g)![]() CH3OH(g)�Ѵ�ƽ��״̬������_______��
CH3OH(g)�Ѵ�ƽ��״̬������_______��
A������Ӧ����ЧӦ��H = -90.8 kJ/mol ʱ��Ӧ�ﵽƽ��״̬
B.�ں��º�ѹ�������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D���ں��º��ݵ������У������ƽ��Ħ���������ٱ仯
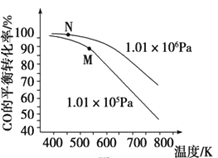
��2���� T1��ʱ�����Ϊ 2 L �ĺ��������г������ʵ���֮��Ϊ 3mol �� H2 ��CO������ʼ n(H2)��n(CO)= 2 ʱ������ 5min �ﵽƽ�⣬CO ��ת����Ϊ 0.6����0~5min ��ƽ����Ӧ���� v (H2)=___�����¶��µ�ƽ�ⳣ��Ϊ__________________ ������ʱ���������м���CO(g) �� CH3OH(g)�� 0.4mol������ƽ��ʱ H2 ��ת���ʽ� ______������� ����С�����䡱����
��3����ҵʵ�ʺϳ� CH3OH �����У�������ͼM�������N���Ӧ�ķ�Ӧ���������û�ѧ��Ӧ���ʺͻ�ѧƽ��֪ʶ��ͬʱ��������ʵ�ʣ�˵��ѡ��÷�Ӧ���������ɣ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 22.4LCl2��������ˮ��������Һ��Cl2��Cl-��HClO��ClO-����������ΪNA
B. ��״���£�38g3H2O2�к���3NA���ۼ�
C. �����£���5.6g����Ͷ������Ũ�����У�ת��0.3NA����
D. 0.1molL-1MgCl2��Һ�к��е�Mg2+��Ŀһ��С��0.1NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com