
【题目】甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____,其核外电子共占据_____个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____,其组成元素的电负性由小到大的顺序为________.
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
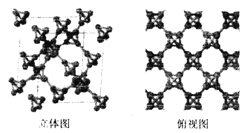
①T-碳与金刚石互称为_________;一个T-碳晶胞中含有______个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石品胞的边长之比为________。
【答案】 ![]() 7 sp3、sp2 H、C、O 10:1 乙酸甲酯不易与水形成氢键,而甲醇易与水形成氢键使甲醇沸点升高,使得乙酸甲酯容易从混合物中蒸出 同素异形体 32 2:1
7 sp3、sp2 H、C、O 10:1 乙酸甲酯不易与水形成氢键,而甲醇易与水形成氢键使甲醇沸点升高,使得乙酸甲酯容易从混合物中蒸出 同素异形体 32 2:1
【解析】(1)①Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,,价层电子的轨道表达式为![]() ,其核外电子共占据7个能级;②甲醇中碳原子的杂化方式为 sp3,而甲醛中碳原子的杂化方式为 sp2,元素非金属性越强电负性越大,则其组成元素C、H、O的电负性由小到大的顺序为H、C、O;(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
,其核外电子共占据7个能级;②甲醇中碳原子的杂化方式为 sp3,而甲醛中碳原子的杂化方式为 sp2,元素非金属性越强电负性越大,则其组成元素C、H、O的电负性由小到大的顺序为H、C、O;(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
①乙酸甲酯分子中除了碳氧双键中含一个![]() 键和一个
键和一个![]() 键外,另有9个
键外,另有9个![]() 键,故
键,故![]() 键和
键和![]() 键的个数之比为10:1;②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,乙酸甲酯不易与水形成氢键,而甲醇易与水形成氢键使甲醇沸点升高,使得乙酸甲酯容易从混合物中蒸出,故工业上用蒸馏的方法分离二者时常先加适量水;(3)①T-碳与金刚石是由碳形成的不同单质,互称为同素异形体;金刚石的晶胞是18个碳原子(顶点8个,面心上下左右前后6个,体内两层对角线各2个共4个),运用切割法, 一个晶胞中的应是
键的个数之比为10:1;②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,乙酸甲酯不易与水形成氢键,而甲醇易与水形成氢键使甲醇沸点升高,使得乙酸甲酯容易从混合物中蒸出,故工业上用蒸馏的方法分离二者时常先加适量水;(3)①T-碳与金刚石是由碳形成的不同单质,互称为同素异形体;金刚石的晶胞是18个碳原子(顶点8个,面心上下左右前后6个,体内两层对角线各2个共4个),运用切割法, 一个晶胞中的应是![]() 个碳原子;T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,故含有碳个数为32个;②T-碳的密度非常小,约为金刚石的一半,而根据构成原子的数目,质量为金刚石的4倍,根据V=
个碳原子;T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,故含有碳个数为32个;②T-碳的密度非常小,约为金刚石的一半,而根据构成原子的数目,质量为金刚石的4倍,根据V=![]() ,T-碳晶胞的体积应该是金刚石的8倍,而边长=
,T-碳晶胞的体积应该是金刚石的8倍,而边长=![]() ,则边长为金刚石的2倍,即T-碳晶胞的边长和金刚石品胞的边长之比为2:1。
,则边长为金刚石的2倍,即T-碳晶胞的边长和金刚石品胞的边长之比为2:1。


科目:高中化学 来源: 题型:
【题目】某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。

下列说法不符合事实的是( )
A. 根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L
B. 根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L
C. 另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀
D. NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。

(1)图一是根据反应Zn + CuSO4 == Cu + ZnSO4 设计成的锌铜原电池。Cu极的电极反应式是________________________________________,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向_______移动(填“甲”或“乙”)。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应式是__________________________________________;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为________________L。
(3)一段时间后,燃料电池的电解质溶液完全转化为K2CO3,以下关系正确的是______________。
A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-)
D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以植物细胞中半纤维素木聚糖为原料合成镇痛药品莫沙朵林(G)的路线:

已知:①四氢呋喃结构式为 ![]() ,在流程中作反应的催化剂;
,在流程中作反应的催化剂;
②双烯合成反应: ;
;
③ .
.
回答下列问题:
(1)B的化学式__;B中官能团的名称_____;
(2)E→G的反应类型______
(3)C与新制氢氧化铜的悬浊液反应的化学方程式为________
(4)D和F的结构简式分别是______、________
(5)写出同时满足下列条件的E的一种同分异构体的简式________
①分子中含有苯环 ②能发生银镜反应 ③能与FeCl3溶液发生显色反应
(6)有机物H(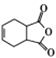 )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3﹣丁二烯为原料制备H的合成路线流程图(无机试剂任用): ________
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3﹣丁二烯为原料制备H的合成路线流程图(无机试剂任用): ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118,质量数为293的新元素,则该元素原子核内的中子数和核外电子数之差为
A.57B.47C.61D.175
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子个数和价电子数都相等的微粒叫等电子体,下列微粒组是等电子体的是( )
A. N2O4和NO2 B. NaCl和MgCl2
C. NO和O2 D. SO![]() 和PO
和PO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有镁、铝合金5.1g完全溶于稀盐酸中,在标准状况下共收集到氢气5.6L,计算:
(1)氢气的物质的量是 。
(2)双线桥法表示出铝和盐酸反应的电子转移的方向和数目?
(3)求这种合金中镁、铝的物质的量分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com