
【题目】现有镁、铝合金5.1g完全溶于稀盐酸中,在标准状况下共收集到氢气5.6L,计算:
(1)氢气的物质的量是 。
(2)双线桥法表示出铝和盐酸反应的电子转移的方向和数目?
(3)求这种合金中镁、铝的物质的量分别是多少?
【答案】(1)0.25mol;(2)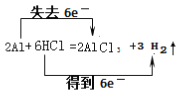 ;(3)Mg、Al的物质的量都是0.1mol
;(3)Mg、Al的物质的量都是0.1mol
【解析】
(1)氢气的物质的量是![]() =0.25mol;(2)铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑,反应中H元素化合价由+1价降低到0价,Al元素化合价由0价升高到+3价,由化合价变化可知,电子转移方向和数目用双线桥法表示为:
=0.25mol;(2)铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑,反应中H元素化合价由+1价降低到0价,Al元素化合价由0价升高到+3价,由化合价变化可知,电子转移方向和数目用双线桥法表示为: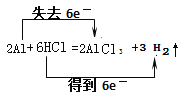 ;(3)设合金中镁、铝的物质的量分别为x、y,根据反应Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,则:
;(3)设合金中镁、铝的物质的量分别为x、y,根据反应Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,则:
24x+27y=5.1g,x+![]() y=0.25mol,联立两式求得x=0.1mol,y=0.1mol。故Mg、Al的物质的量都是0.1mol。
y=0.25mol,联立两式求得x=0.1mol,y=0.1mol。故Mg、Al的物质的量都是0.1mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图所示:
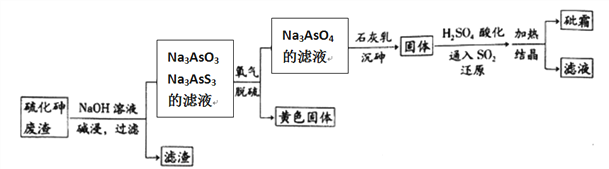
(1)硫化砷中砷元素化合价为__________,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为________________________。
(2)氧化脱硫过程中被氧化的元素是____________。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是____________________。
(4)“沉砷”是在一定温度下将砷元素转化为Ca5(AsO4)3OH沉淀的过程,主要反应有:
a.Ca(OH)2(S)![]() Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S)![]() 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
加入石灰乳调溶液中c(OH-) =0.01mol L-1,此时溶液中c(AsO43-) =________________。(已知: ![]() =2. 15)
=2. 15)
(5)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
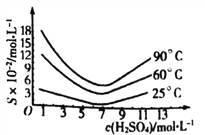
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_________________。
(6)在工业生产中,最后一步所得滤液可循环使用,其目的是____________________。
(7)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式___________________________________________。
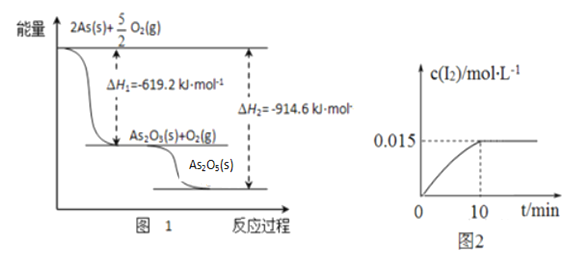
②砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d. ![]() 保持不再变化
保持不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。
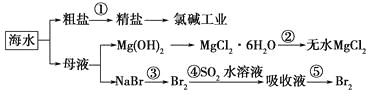
下列有关说法正确的是( )。
A. 第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B. 工业上通过氯碱工业制取金属钠
C. 从第③步到第⑤步的目的是浓缩、富集溴单质
D. 第②步的反应条件是高温加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____,其核外电子共占据_____个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____,其组成元素的电负性由小到大的顺序为________.
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
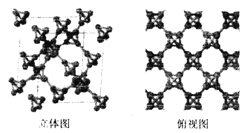
①T-碳与金刚石互称为_________;一个T-碳晶胞中含有______个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石品胞的边长之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
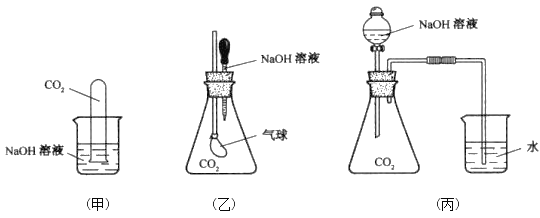
(1)请写出甲实验中CO2与过量的NaOH发生反应的离子方程式:__________。
(2)丙实验装置的实验现象是________________________。
(3)乙实验中,如果二氧化碳和氢氧化物的物质的量之比为1:1.5,且恰好完全反应,溶液中含有的溶质主要是_______________。
A、NaOH 和Na2CO3 B、Na2CO3 C、Na2CO3和NaHCO3 D、NaHCO3
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图:
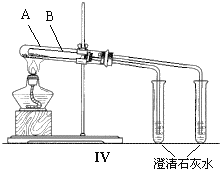
(1)小试管B中应装的药品是________(写化学式)。
(2)和大试管A相连的装有澄清石灰水的小试管中出现的现象预计是____________________。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)称取质量为m1 g的样品溶解后加入过量的CaCl2溶液,将所得沉淀______________(填操作)、洗涤、烘干、称量得到m2 g固体,则Na2CO3的质量分数是_____________________。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,实验结束后,量筒中得到V mL液体,则反应中生成二氧化碳的物质的量是____________(题目中气体体积均已经换算成标准状况),为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠,因为二氧化碳难溶于饱和碳酸氢钠,但选用该溶液后实验结果仍然不够准确,Na2CO3的质量分数偏大,其原因可能是___________。
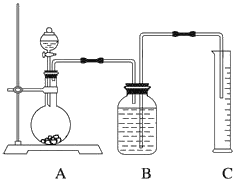
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
![]()
(1)若A为活泼金属单质,D是强碱,则A 与水反应的离子方程式为____________。
(2)已知:C为红棕色气体
①若A是非金属单质气体,试写出D的稀溶液与铜反应的化学方程式_______,在该反应中D体现的性质是_______。
②若A是常见无色有刺激性气味的气体,则A的化学式为________,写出A的一种用途_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是

选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器中充入SO2和只由18O原子组成的氧气(18O2)。在一定条件下达到平衡时,18O存在于
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.SO3、SO2和O2中都有可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com