
【题目】原子个数和价电子数都相等的微粒叫等电子体,下列微粒组是等电子体的是( )
A. N2O4和NO2 B. NaCl和MgCl2
C. NO和O2 D. SO![]() 和PO
和PO![]()
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是
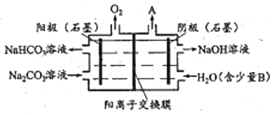
A. 阴极产生的物质A是H2
B. 溶液中Na+由阳极室向阴极室迁移
C. 物质B是NaCl,其作用是增强溶液导电性
D. 阳极OH-放电,H+浓度增大,CO32-转化为HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L HF 中含有氟原子的数目为0.5 NA
B. 2 mol SO2 和1mol O2 混合充分反应后,转移电子的数目为4 NA
C. 46g NO2 和N2O4的混合物中含有氧原子的数目为2 NA
D. 1mol 乙醇分子中含有极性键的数目为8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 大理石与盐酸反应:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+![]() H2O
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____,其核外电子共占据_____个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____,其组成元素的电负性由小到大的顺序为________.
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
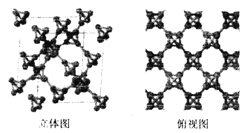
①T-碳与金刚石互称为_________;一个T-碳晶胞中含有______个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石品胞的边长之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是( )
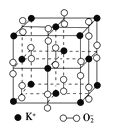
A. 超氧化钾的化学式为KO2,每个晶胞含14个K+和13个O
B. 晶体中每个K+周围有8个O,每个O周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中0价氧原子与-2价氧原子的数目比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为____________________,工艺师常用______(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是___(填化学式,下同),氧化剂是____
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是___(填化学式,下同),氧化剂是____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com